- 首页 > 正文
Nature子刊|一文全解狼疮性肾炎相关CKD的管理理念与未来研究方向
发表时间:2025-05-23 17:38:04
摘要:狼疮性肾炎是系统性红斑狼疮(SLE)的常见并发症,狼疮性肾炎相关慢性肾脏病(CKD)以持续蛋白尿伴或不伴肾小球滤过率(GFR)下降为显著特征,可通过激活肾素-血管紧张素系统(RAS)、肾性贫血等多种病理通路,诱发心血管疾病;同时,CKD所致的免疫代谢紊乱会削弱机体免疫防御,增加感染风险。因此,心血管疾病和感染也成为SLE合并狼疮性肾炎患者的主要致死因素。
当前,狼疮性肾炎的治疗虽侧重于免疫抑制剂的应用,但蛋白尿在CKD背景下的复杂成因使传统治疗策略面临挑战。鉴于此,全面剖析狼疮性肾炎相关CKD的发病机制与危险因素,重新审视治疗目标与策略,对于改善患者预后、降低死亡率和肾衰竭风险至关重要。
一、狼疮性肾炎相关CKD的治疗目标
(一)降低疾病活动度
SLE的疾病活动本质上源于全身性自身免疫异常激活。记忆性T、B细胞及浆细胞的异常克隆扩增与活化,致使机体持续暴露于自身抗原环境,驱动疾病进程。在临床实践中,患者依从性不佳或治疗方案调整不当引发的免疫调节失衡,常与SLE病情复发紧密相关。故而,精准监测并有效控制SLE活动度,是缓解症状、预防器官不可逆损伤的核心环节,对改善患者长期预后意义重大。
(二)预防不可逆的器官损伤
在肾脏局部,增殖性和膜性狼疮性肾炎的持续进展致使足细胞、肾小管上皮细胞等终末分化细胞大量受损、丢失,严重破坏肾脏滤过与代谢功能稳态,引发蛋白尿、GFR下降等系列病理改变。肾脏实质细胞及肾单位的不可逆损伤呈累积性,与年龄相关的肾脏退行性变及其他慢性损伤协同作用,加速肾脏功能衰退,削减肾脏储备功能。狼疮性肾炎的频繁复发可急剧缩短肾脏功能寿命,数次复发即可引发终末期肾衰竭。鉴于CKD与心血管疾病的紧密关联,积极防控狼疮性肾炎相关CKD进展,成为降低SLE心血管并发症风险、提升患者整体健康水平的关键举措。
(三)预防感染相关的发病率
感染是SLE及狼疮性肾炎患者死亡的首要原因之一,其发生机制涉及原发性免疫缺陷、免疫抑制治疗引发的免疫功能受损以及CKD导致的继发性免疫缺陷等多因素交互作用。CKD 状态下,肾脏对免疫调节代谢产物的清除障碍、肠道微生态失衡及肠黏膜屏障功能受损等,共同加剧机体免疫防御缺陷,显著提升感染易感性。因此,探寻非免疫抑制性的CKD干预策略,有效遏制感染相关并发症,成为狼疮性肾炎治疗管理的重要考量方向,有助于优化患者生存质量与预后结局。
二、针对自身免疫因素的治疗策略
SLE以广泛的自身抗原耐受丧失为特征,引发多克隆自身反应性免疫细胞活化。相较于单抗原介导的自身免疫病,其免疫病理机制更为复杂(图1)。B细胞在SLE发病进程中扮演关键角色,它不仅作为浆细胞前体参与自身抗体分泌,还通过抗原呈递激活T细胞,驱动自身免疫炎症反应。因此,B细胞靶向治疗成为调控SLE免疫活性的重要策略方向。深度B细胞耗竭疗法(如CD19靶向CAR-T细胞治疗)在重症SLE治疗中展现出显著疗效,部分患者经治疗后疾病缓解持久,无需长期维持治疗,为新型免疫治疗药物研发提供了有力的临床依据。

图1. 狼疮肾相关性慢性肾脏疾病的免疫学机制
尽管T细胞和浆细胞在SLE免疫病理中亦发挥重要作用,但单一靶向T细胞或浆细胞的治疗方案在单药应用时效果有限,常需与B细胞靶向治疗联合应用,以协同增强免疫调节作用,优化治疗效果。在狼疮性肾炎治疗评估中,肾活检仍是判定肾脏免疫活动度(活动指数)与慢性损伤累积(慢性指数)的金标准。基于T和B细胞的治疗药物见图2。
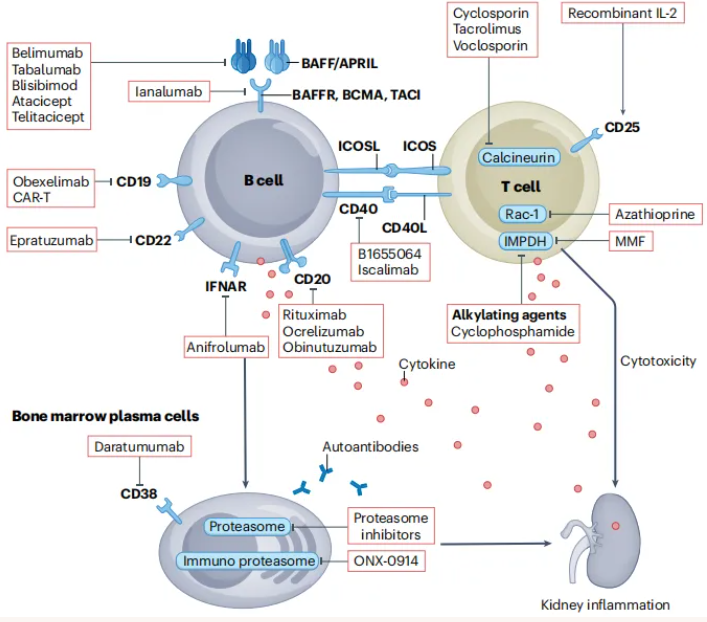
图2. 基于T和B细胞的治疗药物
三、针对非免疫因素的干预措施
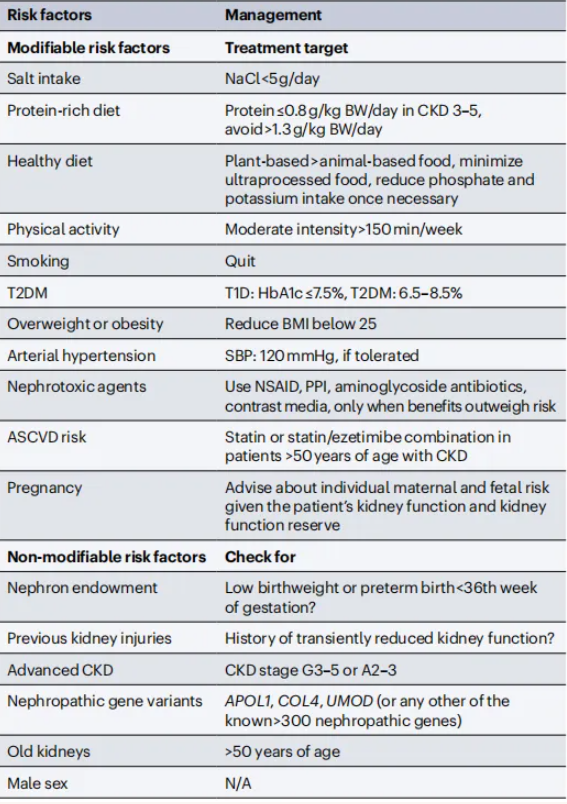
延缓CKD进展需要对可干预因素进行积极调节,包括生活方式调节、饮食调节、运动及合并症等(表1)。针对CKD进展的非免疫因素,临床可选用多种药物进行干预,包括RAS抑制剂、SGLT2抑制剂、盐皮质激素受体拮抗剂。此外,二氢吡啶类钙通道阻滞剂、利尿剂、他汀类药物等在特定CKD患者群体中也展现出一定的肾脏保护与心血管获益。
表1. 狼疮性肾炎相关CKD进展的可干预和不可干预的危险因素
四、诊断与监测的意义及策略
(一)蛋白尿在诊断中的意义与局限
蛋白尿是系统性疾病肾脏受累的关键诊断指标,在SLE患者中,新发蛋白尿通常提示狼疮性肾炎活动,常触发肾脏活检及相应治疗干预。然而,现行指南中蛋白尿诊断阈值未充分考虑肥胖、糖尿病、高盐饮食、妊娠及肾单位数量等因素对蛋白尿水平的影响,可能导致误诊或过度治疗。因此,在临床实践中,应综合评估患者临床特征与危险因素,谨慎解读蛋白尿结果,必要时结合肾脏活检,精准判断肾脏病理状态与疾病活动性。
(二)治疗反应评估中的综合考量
在评估狼疮性肾炎患者免疫调节治疗反应时,需全面考虑非免疫因素对肾脏功能与蛋白尿的影响。对于存在肾小球高滤过因素(如肥胖、糖尿病、肾单位减少等)的患者,即使免疫损伤得到控制,仍可能残留蛋白尿。此类患者可能从针对CKD高滤过的干预措施中获益,而单纯依据蛋白尿缓解判断治疗效果可能存在偏差。尤其在狼疮性肾炎复发患者中,随着肾单位损伤累积与滤过功能下降,蛋白尿作为免疫活动标志物的可靠性逐渐降低,肾脏活检在评估治疗反应与预测肾脏结局方面的价值更为凸显。同时,探寻新型、可靠的非侵入性生物标志物成为临床研究的迫切需求。
(三)监测慢性疾病活动性
在狼疮性肾炎慢性期,持续或加重的蛋白尿常被误判为持续的自身免疫活动,引发免疫调节治疗升级或糖皮质激素减量延迟。然而,实际情况可能是肾单位丢失导致的滤过功能失衡与肾小球高滤过加剧,而非免疫活动失控。因此,在慢性疾病监测过程中,应密切关注患者体重变化、血压波动、饮食摄入及肾功能指标动态演变,综合分析蛋白尿变化原因,避免过度免疫治疗,优化治疗方案调整策略,实现精准医疗管理。
五、狼疮性肾炎相关研究的重点方向
(一)关注肾外免疫记忆形成机制
SLE发病后,自身反应性淋巴细胞克隆在淋巴器官与骨髓中持续活化、扩增,成为驱动疾病进展的关键因素。尽管基因研究有助于识别疾病易感性因素,但难以直接转化为精准治疗靶点。现代免疫治疗策略(如针对浆细胞疾病的克隆定向治疗)为SLE治疗提供了新思路,但鉴于SLE自身抗原的多样性与复杂性,实现真正意义上的克隆定向治疗仍面临巨大挑战。此外,肾脏局部转录组学研究在揭示狼疮性肾炎发病机制方面的价值有限,未来研究应聚焦于系统性免疫调控网络,探索更为有效的免疫调节治疗策略,从根源上干预疾病进程。
(二)肾脏损伤免疫机制的靶向治疗
补体系统激活是狼疮性肾炎肾脏免疫损伤的核心环节之一,补体抑制剂有望替代传统脉冲类固醇疗法,成为早期治疗的新选择。通过蛋白质组学技术精准监测肾脏补体激活水平,可为药物研发与临床应用提供关键依据。同时,足细胞损伤与丢失在蛋白尿发生发展中起关键作用,钙调神经磷酸酶抑制剂在减少蛋白尿方面具有一定疗效,但其长期安全性与肾脏保护作用仍需进一步评估。
(三)基于免疫活性的患者分层研究
当前狼疮性肾炎临床试验在患者招募时,多依据历史病理分类与蛋白尿水平,缺乏明确的免疫活动度分层标准。高免疫活性患者可能从新型免疫治疗中显著获益,而低免疫活性患者接受标准治疗以外的干预措施可能获益甚微,甚至干扰试验结果准确性。因此,建立基于免疫活性的精准患者分层模型,有助于筛选适宜治疗人群,提高临床试验成功率,加速新型药物研发与临床应用进程,为狼疮性肾炎患者提供更为个性化、有效的治疗方案。
(四)探索新型治疗反应标志物
在无合并症的初发狼疮性肾炎患者中,蛋白尿可作为免疫调节治疗反应的有效标志物,但在存在多种并发症或复发性狼疮性肾炎患者中,其可靠性大打折扣,导致部分高效免疫治疗药物因未达蛋白尿终点而被误判。因此,挖掘与肾脏炎症、免疫活动及疾病进展密切相关的新型生物标志物,并通过肾脏活检进行严格验证,成为优化狼疮性肾炎治疗评估体系、推动精准医学发展的关键环节,有望为临床治疗决策提供更为可靠的依据,提升患者治疗效果与预后质量。
六、结论
狼疮性肾炎相关CKD的深入研究极大地拓展了狼疮性肾炎的临床管理范畴,促使治疗理念从单纯免疫调节向综合防控转变(图3),重新审视了蛋白尿在疾病评估中的价值,凸显了多学科协作在优化患者管理中的核心地位。通过全面评估与干预CKD进展的免疫与非免疫因素,精准实施个体化治疗策略,有望显著改善患者预后,降低肾衰竭与心血管疾病风险,提高患者生活质量与长期生存率,为狼疮性肾炎患者的临床诊疗与研究探索开辟新的路径,推动该领域向精准化、高效化方向持续发展。
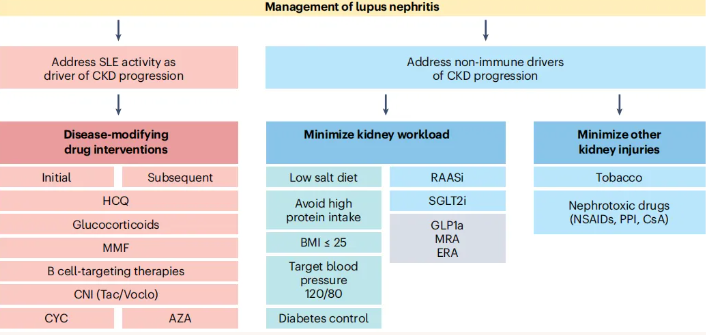
图3. 狼疮性肾炎相关CKD的管理策略
参考文献:Anders HJ, et al. Nature Reviews Rheumatology. 2024; 20: 699-711.
当前,狼疮性肾炎的治疗虽侧重于免疫抑制剂的应用,但蛋白尿在CKD背景下的复杂成因使传统治疗策略面临挑战。鉴于此,全面剖析狼疮性肾炎相关CKD的发病机制与危险因素,重新审视治疗目标与策略,对于改善患者预后、降低死亡率和肾衰竭风险至关重要。
一、狼疮性肾炎相关CKD的治疗目标
(一)降低疾病活动度
SLE的疾病活动本质上源于全身性自身免疫异常激活。记忆性T、B细胞及浆细胞的异常克隆扩增与活化,致使机体持续暴露于自身抗原环境,驱动疾病进程。在临床实践中,患者依从性不佳或治疗方案调整不当引发的免疫调节失衡,常与SLE病情复发紧密相关。故而,精准监测并有效控制SLE活动度,是缓解症状、预防器官不可逆损伤的核心环节,对改善患者长期预后意义重大。
(二)预防不可逆的器官损伤
在肾脏局部,增殖性和膜性狼疮性肾炎的持续进展致使足细胞、肾小管上皮细胞等终末分化细胞大量受损、丢失,严重破坏肾脏滤过与代谢功能稳态,引发蛋白尿、GFR下降等系列病理改变。肾脏实质细胞及肾单位的不可逆损伤呈累积性,与年龄相关的肾脏退行性变及其他慢性损伤协同作用,加速肾脏功能衰退,削减肾脏储备功能。狼疮性肾炎的频繁复发可急剧缩短肾脏功能寿命,数次复发即可引发终末期肾衰竭。鉴于CKD与心血管疾病的紧密关联,积极防控狼疮性肾炎相关CKD进展,成为降低SLE心血管并发症风险、提升患者整体健康水平的关键举措。
(三)预防感染相关的发病率
感染是SLE及狼疮性肾炎患者死亡的首要原因之一,其发生机制涉及原发性免疫缺陷、免疫抑制治疗引发的免疫功能受损以及CKD导致的继发性免疫缺陷等多因素交互作用。CKD 状态下,肾脏对免疫调节代谢产物的清除障碍、肠道微生态失衡及肠黏膜屏障功能受损等,共同加剧机体免疫防御缺陷,显著提升感染易感性。因此,探寻非免疫抑制性的CKD干预策略,有效遏制感染相关并发症,成为狼疮性肾炎治疗管理的重要考量方向,有助于优化患者生存质量与预后结局。
二、针对自身免疫因素的治疗策略
SLE以广泛的自身抗原耐受丧失为特征,引发多克隆自身反应性免疫细胞活化。相较于单抗原介导的自身免疫病,其免疫病理机制更为复杂(图1)。B细胞在SLE发病进程中扮演关键角色,它不仅作为浆细胞前体参与自身抗体分泌,还通过抗原呈递激活T细胞,驱动自身免疫炎症反应。因此,B细胞靶向治疗成为调控SLE免疫活性的重要策略方向。深度B细胞耗竭疗法(如CD19靶向CAR-T细胞治疗)在重症SLE治疗中展现出显著疗效,部分患者经治疗后疾病缓解持久,无需长期维持治疗,为新型免疫治疗药物研发提供了有力的临床依据。

图1. 狼疮肾相关性慢性肾脏疾病的免疫学机制
尽管T细胞和浆细胞在SLE免疫病理中亦发挥重要作用,但单一靶向T细胞或浆细胞的治疗方案在单药应用时效果有限,常需与B细胞靶向治疗联合应用,以协同增强免疫调节作用,优化治疗效果。在狼疮性肾炎治疗评估中,肾活检仍是判定肾脏免疫活动度(活动指数)与慢性损伤累积(慢性指数)的金标准。基于T和B细胞的治疗药物见图2。

图2. 基于T和B细胞的治疗药物
三、针对非免疫因素的干预措施
延缓CKD进展需要对可干预因素进行积极调节,包括生活方式调节、饮食调节、运动及合并症等(表1)。针对CKD进展的非免疫因素,临床可选用多种药物进行干预,包括RAS抑制剂、SGLT2抑制剂、盐皮质激素受体拮抗剂。此外,二氢吡啶类钙通道阻滞剂、利尿剂、他汀类药物等在特定CKD患者群体中也展现出一定的肾脏保护与心血管获益。
表1. 狼疮性肾炎相关CKD进展的可干预和不可干预的危险因素

四、诊断与监测的意义及策略
(一)蛋白尿在诊断中的意义与局限
蛋白尿是系统性疾病肾脏受累的关键诊断指标,在SLE患者中,新发蛋白尿通常提示狼疮性肾炎活动,常触发肾脏活检及相应治疗干预。然而,现行指南中蛋白尿诊断阈值未充分考虑肥胖、糖尿病、高盐饮食、妊娠及肾单位数量等因素对蛋白尿水平的影响,可能导致误诊或过度治疗。因此,在临床实践中,应综合评估患者临床特征与危险因素,谨慎解读蛋白尿结果,必要时结合肾脏活检,精准判断肾脏病理状态与疾病活动性。
(二)治疗反应评估中的综合考量
在评估狼疮性肾炎患者免疫调节治疗反应时,需全面考虑非免疫因素对肾脏功能与蛋白尿的影响。对于存在肾小球高滤过因素(如肥胖、糖尿病、肾单位减少等)的患者,即使免疫损伤得到控制,仍可能残留蛋白尿。此类患者可能从针对CKD高滤过的干预措施中获益,而单纯依据蛋白尿缓解判断治疗效果可能存在偏差。尤其在狼疮性肾炎复发患者中,随着肾单位损伤累积与滤过功能下降,蛋白尿作为免疫活动标志物的可靠性逐渐降低,肾脏活检在评估治疗反应与预测肾脏结局方面的价值更为凸显。同时,探寻新型、可靠的非侵入性生物标志物成为临床研究的迫切需求。
(三)监测慢性疾病活动性
在狼疮性肾炎慢性期,持续或加重的蛋白尿常被误判为持续的自身免疫活动,引发免疫调节治疗升级或糖皮质激素减量延迟。然而,实际情况可能是肾单位丢失导致的滤过功能失衡与肾小球高滤过加剧,而非免疫活动失控。因此,在慢性疾病监测过程中,应密切关注患者体重变化、血压波动、饮食摄入及肾功能指标动态演变,综合分析蛋白尿变化原因,避免过度免疫治疗,优化治疗方案调整策略,实现精准医疗管理。
五、狼疮性肾炎相关研究的重点方向
(一)关注肾外免疫记忆形成机制
SLE发病后,自身反应性淋巴细胞克隆在淋巴器官与骨髓中持续活化、扩增,成为驱动疾病进展的关键因素。尽管基因研究有助于识别疾病易感性因素,但难以直接转化为精准治疗靶点。现代免疫治疗策略(如针对浆细胞疾病的克隆定向治疗)为SLE治疗提供了新思路,但鉴于SLE自身抗原的多样性与复杂性,实现真正意义上的克隆定向治疗仍面临巨大挑战。此外,肾脏局部转录组学研究在揭示狼疮性肾炎发病机制方面的价值有限,未来研究应聚焦于系统性免疫调控网络,探索更为有效的免疫调节治疗策略,从根源上干预疾病进程。
(二)肾脏损伤免疫机制的靶向治疗
补体系统激活是狼疮性肾炎肾脏免疫损伤的核心环节之一,补体抑制剂有望替代传统脉冲类固醇疗法,成为早期治疗的新选择。通过蛋白质组学技术精准监测肾脏补体激活水平,可为药物研发与临床应用提供关键依据。同时,足细胞损伤与丢失在蛋白尿发生发展中起关键作用,钙调神经磷酸酶抑制剂在减少蛋白尿方面具有一定疗效,但其长期安全性与肾脏保护作用仍需进一步评估。
(三)基于免疫活性的患者分层研究
当前狼疮性肾炎临床试验在患者招募时,多依据历史病理分类与蛋白尿水平,缺乏明确的免疫活动度分层标准。高免疫活性患者可能从新型免疫治疗中显著获益,而低免疫活性患者接受标准治疗以外的干预措施可能获益甚微,甚至干扰试验结果准确性。因此,建立基于免疫活性的精准患者分层模型,有助于筛选适宜治疗人群,提高临床试验成功率,加速新型药物研发与临床应用进程,为狼疮性肾炎患者提供更为个性化、有效的治疗方案。
(四)探索新型治疗反应标志物
在无合并症的初发狼疮性肾炎患者中,蛋白尿可作为免疫调节治疗反应的有效标志物,但在存在多种并发症或复发性狼疮性肾炎患者中,其可靠性大打折扣,导致部分高效免疫治疗药物因未达蛋白尿终点而被误判。因此,挖掘与肾脏炎症、免疫活动及疾病进展密切相关的新型生物标志物,并通过肾脏活检进行严格验证,成为优化狼疮性肾炎治疗评估体系、推动精准医学发展的关键环节,有望为临床治疗决策提供更为可靠的依据,提升患者治疗效果与预后质量。
六、结论
狼疮性肾炎相关CKD的深入研究极大地拓展了狼疮性肾炎的临床管理范畴,促使治疗理念从单纯免疫调节向综合防控转变(图3),重新审视了蛋白尿在疾病评估中的价值,凸显了多学科协作在优化患者管理中的核心地位。通过全面评估与干预CKD进展的免疫与非免疫因素,精准实施个体化治疗策略,有望显著改善患者预后,降低肾衰竭与心血管疾病风险,提高患者生活质量与长期生存率,为狼疮性肾炎患者的临床诊疗与研究探索开辟新的路径,推动该领域向精准化、高效化方向持续发展。

图3. 狼疮性肾炎相关CKD的管理策略
参考文献:Anders HJ, et al. Nature Reviews Rheumatology. 2024; 20: 699-711.
- 推荐文章
IgA肾病当前的诊断困境及生物标志物的研究进展
传统 vs. 新型盐皮质激素拮抗剂:谁在护心伤肾?——基于近3万例患者的肾脏安全性大揭秘
患者小课堂|你、我、他,谁更容易患肾脏病?一文速览
病例分享 | 20多岁冶金厂年轻小伙子咳嗽咯血,居然是这种罕见且凶险的肾病在捣乱!
氟氢可的松治疗成功纠正他克莫司诱导的低钠血症病例
世界睡眠日特别提醒!如何应对CKD患者的睡眠障碍
跟随国际IgA肾病联盟主席Jonathan Barratt教授,了解IgA肾病治疗最新进展——WCN 2025回顾
急性肾盂肾炎前瞻观察:哪些因素左右患者出院后的肾脏结局?
紧跟指南,护肾趁早!T2DM相关CKD治疗须与时俱进
肾域华章丨中大一院肾内科研究揭示IgA肾病伴肾病综合征患者的临床病理特征及与预后的关系
容易纠缠不清的病魔!泌尿系感染之肾盂肾炎,不容小觑
APRIL在IgA肾病治疗中的潜力
中国国医节 | 传承与创新:中西合璧挑战狼疮肾炎——黄芪的作用
蛋白尿与年轻人心搏骤停相关——CKD较严重者,风险更高
JASN|补体抑制剂治疗IgA肾病有望实现两个月给药一次?国际IgA肾病领军者Barratt教授最新研究揭晓
病例分享|不期而遇的困扰!丙肝患者短期内出现尿量减少,肌酐升高,警惕罕见的冷球蛋白血症肾病
2025年世界肾脏日:您的肾脏还好吗?早检查=保健康
ADPKD患者肾功能越差,疼痛频率越高,对睡眠的影响越显著
前沿进展|ORIGIN 2期研究结果重磅揭晓:阿塞西普长期治疗IgA肾病有效且安全
患者小课题|别让糖尿病伤了肾——如何早期发现糖尿病肾病
世界肾脏日丨早检查,保健康,拉紧心肾损伤警报线,优化T2DM相关CKD管理策略
Nature子刊|一文全解狼疮性肾炎相关CKD的管理理念与未来研究方向
狼疮性肾炎:突破传统,探索治疗新前沿
IgA肾病:IgA1免疫复合物的面面观
两款药物即将上市!FDA批准呋塞米注射液用于治疗CKD水肿;接受Obinutuzumab治疗狼疮肾炎的补充许可申请
慢性肾脏病患者的“症状关卡”,如何巧妙通关?
“心”感染,“肾”也跟着坏掉?感染性心内膜炎相关性肾炎,究竟是怎么一回事儿?
CKD相关心肌病的早期诊断与规范治疗
睡眠质量差,血液透析患者的“隐形杀手”!
WCN中国之声 | 郝传明教授:低氧诱导因子脯氨酰羟化酶抑制剂在慢性肾脏病贫血治疗中的两面性
探索替尔泊肽在肾脏疾病中的双重激动作用:GLP-1激动剂与潜在GIP介导的获益
什么是CKD相关心肌病?
IgA肾病的新兴疗法与当前争议
警惕!应用噻嗪类利尿剂后出现早期低钠血症,死亡风险或将大幅攀升!
高强度间歇训练显著降低老年人肾功能快速下降风险
指南共识 | 2024 ACR狼疮肾炎诊疗指南更新解读:从序贯治疗到联合免疫靶向的范式转变
病例分享丨中年男子3个月内肾功能快速恶化,原因究竟为何般?这种临床危重症,值得警惕
前沿进展丨常染色体显性多囊肾病患者的肾脏非线性生长模式与不良预后密切相关
糖衣炮弹下的肾脏危机!糖尿病最常见、最严重的并发症之一——糖尿病肾脏疾病
患者小课堂| IgA 肾病:症状背后的真相与应对策略
NEJM丨伊普可泮治疗IgA肾病Ⅲ期临床研究APPLAUSE-IgAN结果揭晓
狼疮性肾炎:流行病学特征与发病机制的最新研究进展
Kidney360|从成像模式看中国ADPKD患者临床特征及肾脏结局走向
NDT丨蛋白尿还是白蛋白尿?IgA肾病风险预测的关键指标再评估
WCN 2025|非奈利酮早期起始,持续治疗对于最大化患者临床效益至关重要
对激素(全身或肠道释放型布地奈德)耐药的肾病综合征范围蛋白尿的IgA肾病:他克莫司能否作为替代药物?
WCN 2025|非奈利酮显著降低蛋白尿,且疗效与安全性不受肾切除术史影响
病例分享 | 血透老人多病共存,内环境如同“纸糊“!棘手局面,肾病科医师如何破局?
WCN 2025|非奈利酮在肾移植后患者中安全有效,值得进一步探索
患者小课堂丨肾虚、肾亏是慢性肾炎吗?
NEJM前沿速递|阿曲生坦治疗IgA肾病Ⅲ期ALIGN试验的中期分析结果正式见刊
微小病变肾病,肾病综合征的第三大原因!“微小”病变也不容忽视,及时准确诊疗很关键
奥妥珠单抗有效保护LN患者的肾功能,显著减少LN发作,还具有减少糖皮质激素使用的潜力:NOBILITY试验事后分析
CKJ|浆细胞与补体或许是MN的潜在治疗靶点
揭秘BAFF、APRIL在IgA肾病中的作用以及治疗研究进展
