- 首页 > 正文
糖衣炮弹下的肾脏危机!糖尿病最常见、最严重的并发症之一——糖尿病肾脏疾病
发表时间:2025-05-23 16:04:22
糖尿病肾脏疾病(DKD)是糖尿病患者重要的致残和致死原因,一旦肾脏被累及出现持续性蛋白尿,则肾脏病变往往不可逆转,最终进入终末期肾功能衰竭(ESRD)。目前DKD所致ESRD需行维持性透析的患者人数逐年增加,世界各国为此耗费了大量人力、物力和财力,因此防治DKD已成为当今医学界的一项重要任务[1]。
一、病理
DKD可累及所有肾脏结构,肾小球、肾小管间质及血管等,均可出现异常,这些变化的严重程度决定了DKD患者的预后。认识DKD的早期肾脏病变,及时给予适当的临床干预措施,对疾病的预后影响重大[2-4]。
(一)光学显微镜检查
1、肾小球病变:肾小球呈硬化性改变,包括弥漫型和结节型2种。前者特征为系膜区的增宽、肾小球基底膜及毛细血管壁的增厚。基质增生处PAS及PASM染色阳性,Masson染色呈蓝绿色。随着病情进展,血管壁的增厚和系膜区的增生将导致血管腔的狭窄和肾脏血流量的下降。结节型病变,又称为Kimmelstiel-Wilson结节(简称K-W结节),为DKD较为特征性的病变之一,光镜下表现为肾小球系膜增生形成结节状硬化,在PAS及PASM染色下呈同心圆状排列(K-W结节)。K-W结节主要位于肾小球毛细血管襻中心区,体积大小不一。
作为ESRD的重要病因,DKD的病理分型一直缺乏共识。为了更好地促进临床医师与肾脏病理医师之间的交流,更有效地指导DKD的预后及干预研究,提高临床治疗的效果,DKD病理分型系统应运而生。
I型,肾小球基底膜增厚:光镜下,活检组织仅有GBM的增厚和轻度非特异性增生。无肾小球系膜区扩大及系膜基质结节状增生(Kimmelstiel-Wilson病变),全球性肾小球硬化不超过50%。GBM增厚是DKD(包括1型和2型)早期的特征性改变,并且随着病程而增加。Ⅱ型,肾小球系膜增生:又分为轻度(Ⅱa)和重度(Ⅱb)。肾活检发现轻至重度肾小球系膜增生,但无结节性硬化(Kimmelstiel-Wilson病变)或全球性肾小球硬化不足50%。Ⅲ型,结节性硬化(Kimmelstiel-Wilson病变):至少有1个肾小球发生系膜基质结节性增生(Kimmelstiel-Wilson病变),但全球性肾小球硬化不足50%。Ⅳ型,晚期糖尿病性肾小球硬化:全球性肾小球硬化程度超过50%,且有其他临床或病理证据支持这一病变为DKD所致。
这一分型系统将有助于深入了解DKD的进展过程,从而提高对DKD患者的诊治水平。
2、小管间质病变:在DKD早期已出现近端小管上皮基底膜的增厚,且往往与GBM增厚相平行。肾间质损害包括间质水肿、炎性细胞(T淋巴细胞、单核细胞、巨噬细胞)浸润。随着肾小球病变进展,小管上皮细胞可出现退行性变,表现为颗粒和空泡样变性,晚期出现肾小管萎缩及肾间质纤维化,与小球改变一起成为DKD晚期的特征性改变。
3、血管病变:DKD是糖尿病全身性微血管病变的一部分,除肾小球外,肾小动脉亦可出现异常,主要表现为入球和出球动脉的透明样变性。出球动脉的透明样变性是DKD相对特异的表现,可用于区别DKD与高血压肾病。而且,动脉的透明样变性与尿白蛋白排泄(UAE)及疾病进展明确相关。
除了特征性的动脉透明样变性之外,肾活检标本还可见到肾动脉及其主要分支的动脉粥样硬化,但缺乏特异性。
4、其他改变:除上述病理改变外,还可表现为肾小球毛细血管基底膜与内皮细胞间嗜伊红物质沉积形成“纤维蛋白帽”,Bowman囊内侧“球囊滴”(capsular drop)的形成等,即所谓的“渗出性病变”。这种病变可能与血浆蛋白及脂质沉积于肾脏(如肾动脉、肾小球毛细血管、Bowman囊、近端集合管等)有关。纤维素帽并非DKD特有,亦可见于FSGS、狼疮性肾炎、动脉硬化性肾小球病变等。球囊滴为DKD较为特征性的病变之一,常见于晚期DKD,且与疾病进展有关。管球结合部的局部粘连、近端小管堵塞形成的管球分离(即无管性肾小球)亦为显性蛋白尿患者晚期表现。
(二)免疫荧光显微镜检查
可见IgG及其他免疫球蛋白呈细线条沉积于肾小球毛细血管壁,可能为血浆蛋白的非特异性附着。
(三)电子显微镜检查
电镜下,可见GBM弥漫性增厚,基质沉积造成系膜区扩张,这些表现早于光镜检查发现。另外,还可见到足细胞形态的改变,包括细胞数目的减少、足突融合等表现。
二、临床表现
1型糖尿病起病症状明显,能够较明确地分析其病程及并发症出现的时间。Mogensen根据1型糖尿病病程、病理生理过程及临床表现将DKD分为以下5期[5]。
I期:肾小球高滤过期。出现了肾小球的高灌注、高压力和高滤过的“三高”现象,但临床无肾病的表现,病理检查仅见肾小球体积增大,无病理组织学的损害。这种DKD的初期改变与血糖水平相关且是可逆的,经过控制血糖可以恢复。
Ⅱ期:正常蛋白尿期。尿中白蛋白排泄(urinary albumin excretion,UAE)正常(UAE<30 mg/24h或<20μg/min),运动后尿白蛋白升高,休息后可恢复。病理检查可见GBM增厚,系膜基质增多。此期GFR仍维持在较高水平,通过严格控制血糖可使GFR降至正常。
Ⅲ期:早期糖尿病肾病期,又称微量白蛋白尿期。患者出现持续性蛋白尿,UAE高于30~300 mg/24h(或20~200μg/min)。此期患者血压开始升高,降压治疗可减少尿白蛋白排泄。病理改变进一步加重,GBM增厚和系膜基质增加更明显,可见弥漫型肾小球硬化及肾小动脉透明样变性。
Ⅳ期:临床糖尿病肾病期或显性糖尿病肾病期。患者出现大量蛋白尿(UAE>300 mg/24h或200μg/min)或尿白蛋白持续升高。临床出现了肾病综合征、高血压,GFR明显下降。病理检查可见结节型肾小球硬化(K-W结节),并出现了部分肾小球荒废现象,残余肾小球代偿性肥大。
V期:终末期肾功能衰竭。糖尿病病人一旦出现持续性尿蛋白发展为临床糖尿病肾病,由于GBM广泛增厚,肾小球毛细血管腔进行性狭窄和更多的肾小球荒废,肾功能将进行性下降,最终导致肾功能衰竭,患者GFR多<10ml/min。临床出现尿毒症及其合并症的相应症状。
Mogensen分期较好地展示了DKD的病理生理演变过程。由于1型和2型DKD临床特点有很多相似之处,所以上述分期系统在一定程度上也适用于2型DKD。亦有学者将DKD分为4期:临床前期(相当于Mogensen I~Ⅱ)、隐性蛋白尿期(尿微量白蛋白超过30 mg/24h)、显性蛋白尿期(尿总蛋白>500 mg/24h、尿白蛋白>200 mg/24h)和晚期DKD(终末期肾衰竭)。
三、诊断及鉴别诊断
临床糖尿病肾病一旦发生,肾脏损害多不可逆,对治疗的效果往往不佳,绝大多数患者在短期内进展至 ESRD。因此,对糖尿病高危人群进行筛查,使糖尿病和DKD能早期发现并得到有效防治具有非常重要的临床意义。KDOQI指南指出1型糖尿病确诊5年后、2型糖尿病确诊后即应每年常规进行糖尿病肾病的筛查。大量白蛋白尿,或微量白蛋白尿合并糖尿病视网膜病变,或1型糖尿病病程超过10年出现微量白蛋白尿大多可确诊为糖尿病肾病。以下为诊断DKD的常用辅助检查[6-8]。
(一)微量白蛋白尿筛查
持续性微量白蛋白尿是早期DKD重要临床表现之一,可通过以下方法进行测定:①随机尿标本测定尿白蛋白/肌酐比(mg/gCr);②留取24h尿测定尿白蛋白含量(UAE)(mg/24h);③定时尿标本测定UAE(μg/min),如留取4h尿或晨尿。微量白蛋白尿定义为UAE30~300 mg/24h(或20~200μg/min或30~300 mg/gCr)。尿白蛋白排泄受许多因素的影响,若患者出现微量白蛋白尿,需除外尿路感染、酮症状态、经血期等情况,并在6个月内复查2次UAE,若均为阳性方可诊断早期 DKD。
(二)肾功能评估
临床上检测出尿微量白蛋白的患者已进入Mogensen糖尿病分期Ⅲ期,而UAE正常的患者部分已存在肾小球的高滤过、肾小球肥大、GBM增厚和系膜基质增加等病理生理变化,还有一部分成人糖尿病无UAE的升高但GFR已明显降低。因此,仅筛查UAE可能延误或漏诊部分DKD。血肌酐(serum creatinine,SCr)不是反应GFR的敏感指标,但可以用来估算GFR从而对慢性肾脏病(chronic kidney disease,CKD)进行分期(表1)。
表1. 慢性肾脏病分期
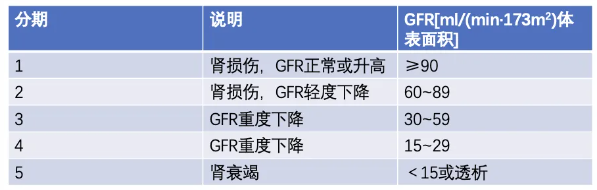
目前根据血肌酐估算GFR的常用公式如下。
(1)简化MDRD公式:GFR[ml/(min·1.73m2)]=186xScr-1.154(mg/dl)x年龄-0.203x(女性0.742)
(2)Cockcroft-Gault公式:Ccr(ml/min)=[(140-年龄)x体重(kg)]/[72xScr(mg/dl)]x(女性0.85)
然而,上述2个公式均存在一些缺陷,可能低估GFR值。ECT肾动态显像可较准确计算GFR,还可反映双肾形态、大小及结构变化等信息,但该法需使用同位素标记,具有放射性且价格昂贵,临床开展并不普遍。
(三)肾活检
糖尿病患者出现肾脏损害可能与糖尿病本身有关,也可能合并其他肾脏病变,即所谓的非糖尿病性肾脏病变(non-diabetic renal disease,NDRD)。因此,临床诊断DKD困难的病例需行肾活检明确病因后进行治疗。肾活检为有创性检查,需严格掌握指征。一般糖尿病诊断明确的患者出现下列情况时考虑进行肾活检:①无糖尿病视网膜病变;②GFR迅速下降;③蛋白尿急剧增多或出现肾病综合征;④顽固性高血压;⑤尿沉渣阳性;⑥存在其他系统性疾病的症状或体征;⑦ACEI或ARB治疗后2~3个月内GFR下降超过30%。
参考文献
[1] Gupta S, et al. Med Clin North Am. 2023 Jul;107(4):689-705.
[2] Thomas MC, et al. Nat Rev Dis Primers. 2015 Jul 30;1:15018.
[3] Reidy K, et al. J Clin Invest. 2014 Jun;124(6):2333-40.
[4] Akhtar M, et al. Adv Anat Pathol. 2020 Mar;27(2):87-97.
[5] Mogensen CE, et al. Diabetes. 1983 May;32 Suppl 2:64-78.
[6] Alicic RZ, et al. Clin J Am Soc Nephrol. 2017 Dec 7;12(12):2032-2045.
[7] Samsu N. Biomed Res Int. 2021 Jul 8;2021:1497449.
[8] Wang N, et al. Int J Mol Sci. 2024 Mar 7;25(6):3086.
一、病理
DKD可累及所有肾脏结构,肾小球、肾小管间质及血管等,均可出现异常,这些变化的严重程度决定了DKD患者的预后。认识DKD的早期肾脏病变,及时给予适当的临床干预措施,对疾病的预后影响重大[2-4]。
(一)光学显微镜检查
1、肾小球病变:肾小球呈硬化性改变,包括弥漫型和结节型2种。前者特征为系膜区的增宽、肾小球基底膜及毛细血管壁的增厚。基质增生处PAS及PASM染色阳性,Masson染色呈蓝绿色。随着病情进展,血管壁的增厚和系膜区的增生将导致血管腔的狭窄和肾脏血流量的下降。结节型病变,又称为Kimmelstiel-Wilson结节(简称K-W结节),为DKD较为特征性的病变之一,光镜下表现为肾小球系膜增生形成结节状硬化,在PAS及PASM染色下呈同心圆状排列(K-W结节)。K-W结节主要位于肾小球毛细血管襻中心区,体积大小不一。
作为ESRD的重要病因,DKD的病理分型一直缺乏共识。为了更好地促进临床医师与肾脏病理医师之间的交流,更有效地指导DKD的预后及干预研究,提高临床治疗的效果,DKD病理分型系统应运而生。
I型,肾小球基底膜增厚:光镜下,活检组织仅有GBM的增厚和轻度非特异性增生。无肾小球系膜区扩大及系膜基质结节状增生(Kimmelstiel-Wilson病变),全球性肾小球硬化不超过50%。GBM增厚是DKD(包括1型和2型)早期的特征性改变,并且随着病程而增加。Ⅱ型,肾小球系膜增生:又分为轻度(Ⅱa)和重度(Ⅱb)。肾活检发现轻至重度肾小球系膜增生,但无结节性硬化(Kimmelstiel-Wilson病变)或全球性肾小球硬化不足50%。Ⅲ型,结节性硬化(Kimmelstiel-Wilson病变):至少有1个肾小球发生系膜基质结节性增生(Kimmelstiel-Wilson病变),但全球性肾小球硬化不足50%。Ⅳ型,晚期糖尿病性肾小球硬化:全球性肾小球硬化程度超过50%,且有其他临床或病理证据支持这一病变为DKD所致。
这一分型系统将有助于深入了解DKD的进展过程,从而提高对DKD患者的诊治水平。
2、小管间质病变:在DKD早期已出现近端小管上皮基底膜的增厚,且往往与GBM增厚相平行。肾间质损害包括间质水肿、炎性细胞(T淋巴细胞、单核细胞、巨噬细胞)浸润。随着肾小球病变进展,小管上皮细胞可出现退行性变,表现为颗粒和空泡样变性,晚期出现肾小管萎缩及肾间质纤维化,与小球改变一起成为DKD晚期的特征性改变。
3、血管病变:DKD是糖尿病全身性微血管病变的一部分,除肾小球外,肾小动脉亦可出现异常,主要表现为入球和出球动脉的透明样变性。出球动脉的透明样变性是DKD相对特异的表现,可用于区别DKD与高血压肾病。而且,动脉的透明样变性与尿白蛋白排泄(UAE)及疾病进展明确相关。
除了特征性的动脉透明样变性之外,肾活检标本还可见到肾动脉及其主要分支的动脉粥样硬化,但缺乏特异性。
4、其他改变:除上述病理改变外,还可表现为肾小球毛细血管基底膜与内皮细胞间嗜伊红物质沉积形成“纤维蛋白帽”,Bowman囊内侧“球囊滴”(capsular drop)的形成等,即所谓的“渗出性病变”。这种病变可能与血浆蛋白及脂质沉积于肾脏(如肾动脉、肾小球毛细血管、Bowman囊、近端集合管等)有关。纤维素帽并非DKD特有,亦可见于FSGS、狼疮性肾炎、动脉硬化性肾小球病变等。球囊滴为DKD较为特征性的病变之一,常见于晚期DKD,且与疾病进展有关。管球结合部的局部粘连、近端小管堵塞形成的管球分离(即无管性肾小球)亦为显性蛋白尿患者晚期表现。
(二)免疫荧光显微镜检查
可见IgG及其他免疫球蛋白呈细线条沉积于肾小球毛细血管壁,可能为血浆蛋白的非特异性附着。
(三)电子显微镜检查
电镜下,可见GBM弥漫性增厚,基质沉积造成系膜区扩张,这些表现早于光镜检查发现。另外,还可见到足细胞形态的改变,包括细胞数目的减少、足突融合等表现。
二、临床表现
1型糖尿病起病症状明显,能够较明确地分析其病程及并发症出现的时间。Mogensen根据1型糖尿病病程、病理生理过程及临床表现将DKD分为以下5期[5]。
I期:肾小球高滤过期。出现了肾小球的高灌注、高压力和高滤过的“三高”现象,但临床无肾病的表现,病理检查仅见肾小球体积增大,无病理组织学的损害。这种DKD的初期改变与血糖水平相关且是可逆的,经过控制血糖可以恢复。
Ⅱ期:正常蛋白尿期。尿中白蛋白排泄(urinary albumin excretion,UAE)正常(UAE<30 mg/24h或<20μg/min),运动后尿白蛋白升高,休息后可恢复。病理检查可见GBM增厚,系膜基质增多。此期GFR仍维持在较高水平,通过严格控制血糖可使GFR降至正常。
Ⅲ期:早期糖尿病肾病期,又称微量白蛋白尿期。患者出现持续性蛋白尿,UAE高于30~300 mg/24h(或20~200μg/min)。此期患者血压开始升高,降压治疗可减少尿白蛋白排泄。病理改变进一步加重,GBM增厚和系膜基质增加更明显,可见弥漫型肾小球硬化及肾小动脉透明样变性。
Ⅳ期:临床糖尿病肾病期或显性糖尿病肾病期。患者出现大量蛋白尿(UAE>300 mg/24h或200μg/min)或尿白蛋白持续升高。临床出现了肾病综合征、高血压,GFR明显下降。病理检查可见结节型肾小球硬化(K-W结节),并出现了部分肾小球荒废现象,残余肾小球代偿性肥大。
V期:终末期肾功能衰竭。糖尿病病人一旦出现持续性尿蛋白发展为临床糖尿病肾病,由于GBM广泛增厚,肾小球毛细血管腔进行性狭窄和更多的肾小球荒废,肾功能将进行性下降,最终导致肾功能衰竭,患者GFR多<10ml/min。临床出现尿毒症及其合并症的相应症状。
Mogensen分期较好地展示了DKD的病理生理演变过程。由于1型和2型DKD临床特点有很多相似之处,所以上述分期系统在一定程度上也适用于2型DKD。亦有学者将DKD分为4期:临床前期(相当于Mogensen I~Ⅱ)、隐性蛋白尿期(尿微量白蛋白超过30 mg/24h)、显性蛋白尿期(尿总蛋白>500 mg/24h、尿白蛋白>200 mg/24h)和晚期DKD(终末期肾衰竭)。
三、诊断及鉴别诊断
临床糖尿病肾病一旦发生,肾脏损害多不可逆,对治疗的效果往往不佳,绝大多数患者在短期内进展至 ESRD。因此,对糖尿病高危人群进行筛查,使糖尿病和DKD能早期发现并得到有效防治具有非常重要的临床意义。KDOQI指南指出1型糖尿病确诊5年后、2型糖尿病确诊后即应每年常规进行糖尿病肾病的筛查。大量白蛋白尿,或微量白蛋白尿合并糖尿病视网膜病变,或1型糖尿病病程超过10年出现微量白蛋白尿大多可确诊为糖尿病肾病。以下为诊断DKD的常用辅助检查[6-8]。
(一)微量白蛋白尿筛查
持续性微量白蛋白尿是早期DKD重要临床表现之一,可通过以下方法进行测定:①随机尿标本测定尿白蛋白/肌酐比(mg/gCr);②留取24h尿测定尿白蛋白含量(UAE)(mg/24h);③定时尿标本测定UAE(μg/min),如留取4h尿或晨尿。微量白蛋白尿定义为UAE30~300 mg/24h(或20~200μg/min或30~300 mg/gCr)。尿白蛋白排泄受许多因素的影响,若患者出现微量白蛋白尿,需除外尿路感染、酮症状态、经血期等情况,并在6个月内复查2次UAE,若均为阳性方可诊断早期 DKD。
(二)肾功能评估
临床上检测出尿微量白蛋白的患者已进入Mogensen糖尿病分期Ⅲ期,而UAE正常的患者部分已存在肾小球的高滤过、肾小球肥大、GBM增厚和系膜基质增加等病理生理变化,还有一部分成人糖尿病无UAE的升高但GFR已明显降低。因此,仅筛查UAE可能延误或漏诊部分DKD。血肌酐(serum creatinine,SCr)不是反应GFR的敏感指标,但可以用来估算GFR从而对慢性肾脏病(chronic kidney disease,CKD)进行分期(表1)。
表1. 慢性肾脏病分期

目前根据血肌酐估算GFR的常用公式如下。
(1)简化MDRD公式:GFR[ml/(min·1.73m2)]=186xScr-1.154(mg/dl)x年龄-0.203x(女性0.742)
(2)Cockcroft-Gault公式:Ccr(ml/min)=[(140-年龄)x体重(kg)]/[72xScr(mg/dl)]x(女性0.85)
然而,上述2个公式均存在一些缺陷,可能低估GFR值。ECT肾动态显像可较准确计算GFR,还可反映双肾形态、大小及结构变化等信息,但该法需使用同位素标记,具有放射性且价格昂贵,临床开展并不普遍。
(三)肾活检
糖尿病患者出现肾脏损害可能与糖尿病本身有关,也可能合并其他肾脏病变,即所谓的非糖尿病性肾脏病变(non-diabetic renal disease,NDRD)。因此,临床诊断DKD困难的病例需行肾活检明确病因后进行治疗。肾活检为有创性检查,需严格掌握指征。一般糖尿病诊断明确的患者出现下列情况时考虑进行肾活检:①无糖尿病视网膜病变;②GFR迅速下降;③蛋白尿急剧增多或出现肾病综合征;④顽固性高血压;⑤尿沉渣阳性;⑥存在其他系统性疾病的症状或体征;⑦ACEI或ARB治疗后2~3个月内GFR下降超过30%。
参考文献
[1] Gupta S, et al. Med Clin North Am. 2023 Jul;107(4):689-705.
[2] Thomas MC, et al. Nat Rev Dis Primers. 2015 Jul 30;1:15018.
[3] Reidy K, et al. J Clin Invest. 2014 Jun;124(6):2333-40.
[4] Akhtar M, et al. Adv Anat Pathol. 2020 Mar;27(2):87-97.
[5] Mogensen CE, et al. Diabetes. 1983 May;32 Suppl 2:64-78.
[6] Alicic RZ, et al. Clin J Am Soc Nephrol. 2017 Dec 7;12(12):2032-2045.
[7] Samsu N. Biomed Res Int. 2021 Jul 8;2021:1497449.
[8] Wang N, et al. Int J Mol Sci. 2024 Mar 7;25(6):3086.
- 推荐文章
IgA肾病当前的诊断困境及生物标志物的研究进展
传统 vs. 新型盐皮质激素拮抗剂:谁在护心伤肾?——基于近3万例患者的肾脏安全性大揭秘
患者小课堂|你、我、他,谁更容易患肾脏病?一文速览
病例分享 | 20多岁冶金厂年轻小伙子咳嗽咯血,居然是这种罕见且凶险的肾病在捣乱!
氟氢可的松治疗成功纠正他克莫司诱导的低钠血症病例
世界睡眠日特别提醒!如何应对CKD患者的睡眠障碍
跟随国际IgA肾病联盟主席Jonathan Barratt教授,了解IgA肾病治疗最新进展——WCN 2025回顾
急性肾盂肾炎前瞻观察:哪些因素左右患者出院后的肾脏结局?
紧跟指南,护肾趁早!T2DM相关CKD治疗须与时俱进
肾域华章丨中大一院肾内科研究揭示IgA肾病伴肾病综合征患者的临床病理特征及与预后的关系
容易纠缠不清的病魔!泌尿系感染之肾盂肾炎,不容小觑
APRIL在IgA肾病治疗中的潜力
中国国医节 | 传承与创新:中西合璧挑战狼疮肾炎——黄芪的作用
蛋白尿与年轻人心搏骤停相关——CKD较严重者,风险更高
JASN|补体抑制剂治疗IgA肾病有望实现两个月给药一次?国际IgA肾病领军者Barratt教授最新研究揭晓
病例分享|不期而遇的困扰!丙肝患者短期内出现尿量减少,肌酐升高,警惕罕见的冷球蛋白血症肾病
2025年世界肾脏日:您的肾脏还好吗?早检查=保健康
ADPKD患者肾功能越差,疼痛频率越高,对睡眠的影响越显著
前沿进展|ORIGIN 2期研究结果重磅揭晓:阿塞西普长期治疗IgA肾病有效且安全
患者小课题|别让糖尿病伤了肾——如何早期发现糖尿病肾病
世界肾脏日丨早检查,保健康,拉紧心肾损伤警报线,优化T2DM相关CKD管理策略
Nature子刊|一文全解狼疮性肾炎相关CKD的管理理念与未来研究方向
狼疮性肾炎:突破传统,探索治疗新前沿
IgA肾病:IgA1免疫复合物的面面观
两款药物即将上市!FDA批准呋塞米注射液用于治疗CKD水肿;接受Obinutuzumab治疗狼疮肾炎的补充许可申请
慢性肾脏病患者的“症状关卡”,如何巧妙通关?
“心”感染,“肾”也跟着坏掉?感染性心内膜炎相关性肾炎,究竟是怎么一回事儿?
CKD相关心肌病的早期诊断与规范治疗
睡眠质量差,血液透析患者的“隐形杀手”!
WCN中国之声 | 郝传明教授:低氧诱导因子脯氨酰羟化酶抑制剂在慢性肾脏病贫血治疗中的两面性
探索替尔泊肽在肾脏疾病中的双重激动作用:GLP-1激动剂与潜在GIP介导的获益
什么是CKD相关心肌病?
IgA肾病的新兴疗法与当前争议
警惕!应用噻嗪类利尿剂后出现早期低钠血症,死亡风险或将大幅攀升!
高强度间歇训练显著降低老年人肾功能快速下降风险
指南共识 | 2024 ACR狼疮肾炎诊疗指南更新解读:从序贯治疗到联合免疫靶向的范式转变
病例分享丨中年男子3个月内肾功能快速恶化,原因究竟为何般?这种临床危重症,值得警惕
前沿进展丨常染色体显性多囊肾病患者的肾脏非线性生长模式与不良预后密切相关
糖衣炮弹下的肾脏危机!糖尿病最常见、最严重的并发症之一——糖尿病肾脏疾病
患者小课堂| IgA 肾病:症状背后的真相与应对策略
NEJM丨伊普可泮治疗IgA肾病Ⅲ期临床研究APPLAUSE-IgAN结果揭晓
狼疮性肾炎:流行病学特征与发病机制的最新研究进展
Kidney360|从成像模式看中国ADPKD患者临床特征及肾脏结局走向
NDT丨蛋白尿还是白蛋白尿?IgA肾病风险预测的关键指标再评估
WCN 2025|非奈利酮早期起始,持续治疗对于最大化患者临床效益至关重要
对激素(全身或肠道释放型布地奈德)耐药的肾病综合征范围蛋白尿的IgA肾病:他克莫司能否作为替代药物?
WCN 2025|非奈利酮显著降低蛋白尿,且疗效与安全性不受肾切除术史影响
病例分享 | 血透老人多病共存,内环境如同“纸糊“!棘手局面,肾病科医师如何破局?
WCN 2025|非奈利酮在肾移植后患者中安全有效,值得进一步探索
患者小课堂丨肾虚、肾亏是慢性肾炎吗?
NEJM前沿速递|阿曲生坦治疗IgA肾病Ⅲ期ALIGN试验的中期分析结果正式见刊
微小病变肾病,肾病综合征的第三大原因!“微小”病变也不容忽视,及时准确诊疗很关键
奥妥珠单抗有效保护LN患者的肾功能,显著减少LN发作,还具有减少糖皮质激素使用的潜力:NOBILITY试验事后分析
CKJ|浆细胞与补体或许是MN的潜在治疗靶点
揭秘BAFF、APRIL在IgA肾病中的作用以及治疗研究进展
