- 首页 > 正文
WCN 2025|非奈利酮早期起始,持续治疗对于最大化患者临床效益至关重要
发表时间:2025-05-23 15:51:23
引言
非奈利酮作为一种新型非甾体盐皮质激素受体拮抗剂(ns-MRA),通过全面阻断盐皮质激素受体(MR)过度激活,强效精准阻断炎症与纤维化进程,直接全面保护心肾靶器官,现已成为T2DM相关CKD的一线治疗药物并广泛应用于临床。然而,影响其治疗中断的因素及中断治疗对心肾预后的影响仍需进一步研究。
在2025年世界肾脏病学大会(WCN 2025)上,一项FIDELITY事后分析结果发布[1],该研究探讨了非奈利酮治疗提前中断的预测因素,并评估了其治疗中断对T2DM相关CKD患者肾脏和心血管结局的影响。本刊特邀四川大学华西医院付平教授对此进行点评,以期为非奈利酮的临床实践优化提供重要见解。
研究设计与方法
FIDELITY研究是对FIDELIO-DKD和FIGARO-DKD两项Ⅲ试验的汇总分析,涵盖了G1-G4期广泛T2DM相关CKD患者。该研究是基于FIDELITY研究的预设汇总分析,共纳入了12 990例患者,随机接受非奈利酮或安慰剂治疗(1:1),中位随访时间为3年。
该研究评估了非奈利酮治疗中断的预测因素,以及非奈利酮治疗中断后对肾脏复合结局及心血管复合结局的影响(肾脏复合结局定义为肾脏衰竭、eGFR持续下降≥57%或肾脏相关死亡;心血管复合结局定义为心血管死亡、非致死性心肌梗死、非致死性卒中或因心力衰竭住院)。研究设计、FIDELIO-DKD和FIGARO-DKD的关键入选标准以及FIDELITY事后分析中评估的关键结局如图1所示。
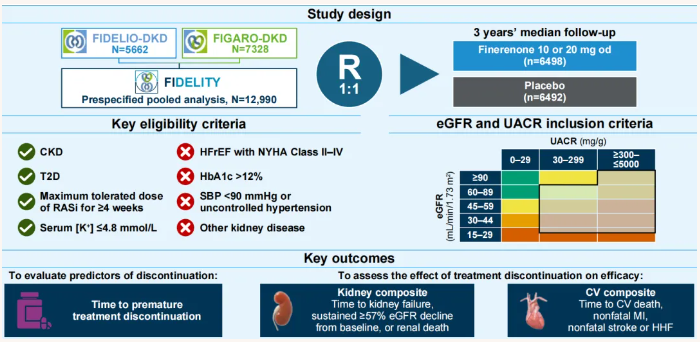
图1. 研究设计、关键入选标准以及主要研究终点
统计分析
1.基线人口统计学特征、治疗中断原因及疗效结局分析:该分析纳入了所有随机化参与者,但排除了严重违反药品临床试验管理范(GCP)的个体。
2.治疗中断预测因素的识别与评估:在安全性分析集中进行,该集包括至少服用过一剂研究药物且未严重违反GCP的随机化参与者。
3.预测因素的选择:基于临床相关因素和单变量Cox模型观察到的差异,选择基线特征作为治疗中断的潜在预测因素。采用基于Akaike信息准则的自动变量选择方法,通过多变量Cox比例风险模型分析确定的预测因素。
4.治疗中断对疗效结局的影响:使用分层Cox模型评估,将治疗中断作为时间依赖性协变量。
5.治疗效果的表达:Cox比例风险模型得出的治疗效果以风险比(HR)及其95%置信区间(CI)表示。
6.分析软件:所有分析均使用SAS软件(版本9.4,SAS Institute Inc.)完成。
研究结果
参与者基线特征
在全分析集的12 990名参与者中,2889名(22.2%)因非死亡原因提前中断治疗(非奈利酮组:22.8%;安慰剂组:21.6%),10 101名(77.8%)继续治疗(非奈利酮组:77.2%;安慰剂组:78.4%)。两组间的基线特征和药物使用情况总体平衡,但提前中断治疗的参与者与未中断治疗的参与者在某些关键特征上存在差异。
提前中断治疗的原因
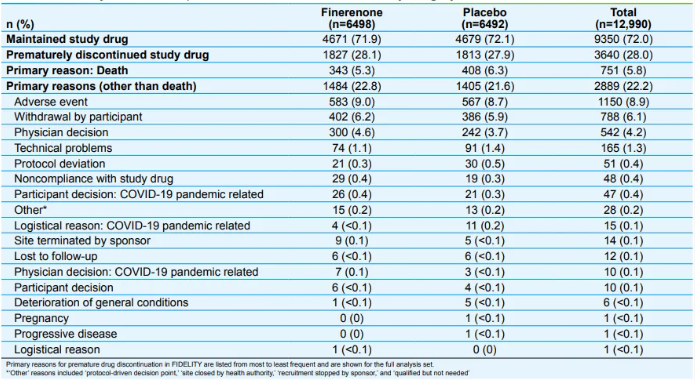
两组中提前中断研究药物治疗的主要原因均为不良事件的发生(非奈利酮组:9.0%;安慰剂组:8.7%)(表1)。非奈利酮组因治疗相关不良事件导致药物中断的发生率略高于安慰剂组(非奈利酮组:6.4%;安慰剂组:5.4%)。因高钾血症导致治疗中断的比例在两组中均较低(非奈利酮组:1.7%;安慰剂组:0.6%)。
表1. 各治疗组提前停止研究药物的主要原因
治疗中断的预测因素
在非奈利酮组中,年龄较大、黑人和白人种族(相对于亚洲人)、较低的eGFR、较高的UACR和较高的血清钾水平与治疗中断风险增加相关(图2)。交互分析显示,非奈利酮组和安慰剂组在基线特征对治疗中断的影响方面未发现显著异质性。
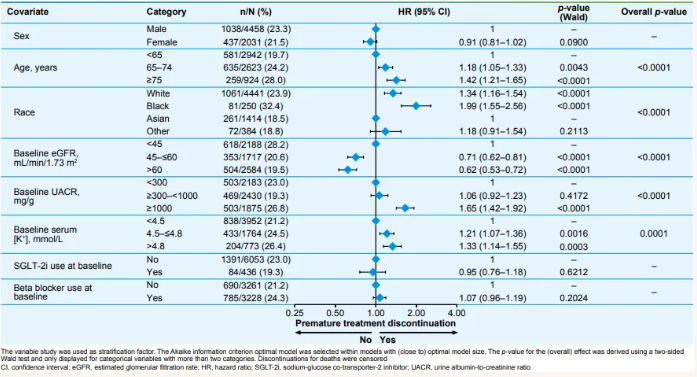
图2. 多变量Cox模型评估非奈利酮组提前中断治疗的预测因素
非奈利酮治疗中断对肾脏以及心血管复合结局的影响
与治疗期间相比,非奈利酮对复合肾脏结局的治疗效果在治疗中断后有所减弱(HR=0.82;95%CI:0.66~1.02),而治疗期间为HR=0.65;95%CI:0.54~0.78;P=0.0959)。对于复合心血管结局,非奈利酮的治疗效果在治疗中断后也有所下降(HR=0.93;95%CI 0.79~1.09),而治疗期间为HR=0.79;95%CI:0.70~0.88;P=0.0960)(图3)。该结果提示提前中断治疗可使非奈利酮对肾脏和心血管结局的积极作用减弱。
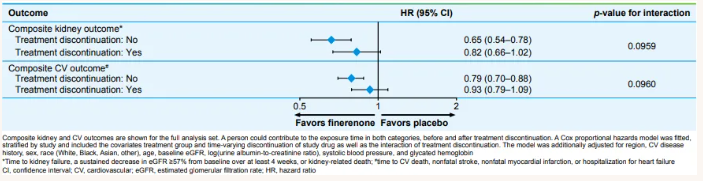
图3. 非奈利酮提前中断治疗对肾脏和心血管复合结局的影响
研究结论
总体而言,非奈利酮组的中断治疗率较低,与安慰剂相当,不良反应的发生是最常见的原因,且两组因高钾血症而中断治疗的比例均较低。中断治疗风险随着年龄增长、黑人和白人种族、较低的eGFR、较高的UACR和较高的血钾水平而增加,并未发现这些风险因素在非奈利酮组和安慰剂组之间有显著差异。需要强调的是,非奈利酮持续治疗的心肾获益优于中断治疗。
专家点评

非奈利酮早期起始,20 mg标准剂量持续治疗以最大化心肾获益
炎症和纤维化是T2DM相关CKD发生和进展的核心驱动因素,早期炎症和纤维化指标的升高与心肾不良事件及死亡风险显著相关。因此,早期启动抗炎和抗纤维化干预至关重要。传统药物如RASi和SGLT2i主要通过调节血流动力学和代谢途径发挥作用,无法直接、全面地抑制炎症和纤维化进程[2-6]。非奈利酮填补了靶向炎症和纤维化治疗的空白。
非奈利酮是全球首个获批用于T2DM相关CKD治疗的新型ns-MRA,与RASi/SGLT2i相比,非奈利酮通过靶向精准抗炎抗纤维化,直接全面保护心肾靶器官,直击疾病本质。同时,其作用位点分布较RASi/SGLT2i更广泛,能够更直接、全面地发挥心肾保护作用。III期临床研究FIDELIO-DKD、FIGARO-DKD及FIDELITY证实,非奈利酮显著降低T2DM相关CKD患者的心肾事件风险,奠定了其作为一线标准治疗的地位[7-9]。在中国人群中,非奈利酮展现出更显著的肾脏获益和多维心血管获益,显著降低蛋白尿,尤其适合中国患者。
这项FIDELITY事后分析结果强调了非奈利酮早期起始,持续治疗对于最大化非奈利酮的临床效益至关重要。为实现最大化非奈利酮的临床价值,对非奈利酮的临床使用建议如下:
早期起始治疗
我国T2DM和CKD患者基数庞大,且早期(G1-G2期)患者占比高达73.3%[10],为早期干预提供了重要机会。对于G1-G2期患者,尽管肾功能尚可,但CV风险已经显著升高,因此,G1-G2期患者应加强对CV风险的早期干预。FIGARO-DKD研究表明,早期启用非奈利酮可显著降低心血管复合终点风险13%,新发心衰风险32%[8]。
随着疾病进展,CKD患者可能面临更高的不良事件风险,容易错失最佳治疗时机。与G3-G4人群相比,G1-G2期患者使用非奈利酮的高钾血症发生率更低,耐受性更好。FINE-REAL中期分析显示,中国真实世界中,非奈利酮起始患者中G1-G2期占比45%,总体耐受性良好,高钾血症发生率低[11-12]。该研究也表明,eGFR>60 ml/min/1.73m2的患者起始非奈利酮治疗有利于减少非奈利酮治疗中断的风险,提高患者的依从性,最大化患者的肾心获益。
20 mg标准剂量使用
ARTS-DN研究和FIDELIO-PK/PD模型证实,非奈利酮的疗效与剂量呈显著正相关[13-14]。III期研究中,非奈利酮平均剂量为15.1 mg(FIDELIO-DKD)和17.5mg(FIGARO-DKD),推荐20 mg标准剂量长期治疗以最大化获益[7-8]。
长期治疗,持续获益
T2DM相关CKD患者治疗应以改善心肾结局为目标。非奈利酮不仅显著降低蛋白尿,更能通过靶向抗炎抗纤维化提供持续的心肾靶器官保护。既往研究表明,非奈利酮停药后1个月,UACR显著增高,重启非奈利酮治疗后UACR显著下降[13]。该研究也表明,非奈利酮中断治疗后心肾保护作用减弱[1]。因此,在临床实践中,不能将非奈利酮仅作为降低“蛋白尿”的药物,长期治疗是最大化非奈利酮临床价值的关键。
总结
T2DM相关CKD是一种慢性进展性疾病,若未得到充分治疗,可能引发终末期肾病(ESRD)和心力衰竭(HF),因为肾脏损伤与心血管(CV)并发症通过共同的病理生理机制相互影响,因此,心肾靶器官保护应贯穿疾病管理的全程。非奈利酮作为权威指南推荐的一线标准治疗药物,通过靶向精准抑制炎症和纤维化进程,显著降低T2DM相关CKD患者肾脏和心血管事件风险。最新FIDELITY事后分析表明,非奈利酮早期起始、使用20mg标准剂量持续治疗,可有效提高患者依从性,减少治疗中断风险,最大化长期心肾的保护作用。
付平 教授
四川大学华西医院
二级教授/主任医师,博士/博士后合作导师
四川大学华西医院肾脏内科主任/华西肾脏病研究所所长
国际肾脏病学者(ISN Scholar),《中华医学杂志英文版》等23种杂志编委
国家重点研发计划等27项课题负责人
以第一作者和通讯作者发表论文400余篇,其中SCI收录150余篇,包括JASN,Cell research,STTT等国际著名期刊
主编人民卫生出版教材和专著各一部
中华医学会科技进步二等奖,华夏医学科技进步二等奖及四川省科技进步一等奖各一项
国家发明及实用新技术专利31项,转化6项,其中一项2016年进国家基本医保目录,软著7项,转化5项
中华医学会肾脏病学分会8.9.10届常委
中国医师协会肾脏内科分会常委
中国医院协会血液净化中心分会副主任委员
中国中药协会肾病中药发展研究专委会主任委员
世界华人肾脏医师协会副会长
中国药理学会肾脏药理专委会常委
四川省医学会肾脏病专委会主任委员
四川省医师协会肾脏内科医师分会会长
四川省国际医学交流促进会肾脏分会会长
参考文献
1.Anker S, et al. WCN25-288#EFFECT OF FINERENONE TREATMENT DISCONTINUATION ON KIDNEY AND CV OUTCOMES IN PATIENTS WITH CKD AND T2D: A FIDELITY SUBANALYSIS. Kidney International Reports. 2025; 10: S1-S773.
2.Bomback AS, et al. Nat Clin Pract Nephrol. 2007 Sep,3(9):486-922.
3.Bauersachs J,et al.Hypertension.2015 Feb:65(2):257-63.2
4.Dong H,et al Signal Transduct Target Ther 2024 Feb 28:9(1).38
5.FolzR,Laiteerapong N,Diabetologia.2021 0ct64(10)2131-21375.
6.Ceriello A,et al. Lancet Reg Health Eur. 2023 Jun 12.31:100666.
7.Bakris GL, et al. N Engl J Med. 2020; 383(23): 2219-2229.
8.Pitt B, et al. N Engl J Med. 2021; 385(24): 2252-2263.
9.Agarwal R, et al. Eur Heart J. 2022 Feb 10;43(6):474-484.
10.DALONG ZHU, et al. 1373-P: The Prevalence and Risk Factors of Chronic Kidney Disease in Patients with Type 2 Diabetes in China—A Cross-Sectional Study. 2023 ADA.
11.Bayer. https://clinicaltrials.gov/study/NCT05703880 [accessed 5 Apr 2024].
12.Kovesdy C, et al. ERA 2024; poster (abstract 2022).
13.Bakris GL, et al. JAMA 2015; 314: 884-894.
14. Goulooze SC, et al. Clin Pharmacokinet. 2022; 61(7): 1013-1025.
审批号:PP-KER-CN-1133-1
仅供与医疗卫生专业人士学术沟通使用
非奈利酮说明书.可申达®(非奈利酮片)简明处方信息:
【药品名称】通用名称: 非奈利酮片 商品名称: 可申达?(Kerendia?)
【成份】本品主要成份为非奈利酮
【适应症】本品用于与2型糖尿病相关的慢性肾脏病成人患者(伴白蛋白尿),以降低eGFR持续下降、终末期肾病、心血管死亡和因心力衰竭住院的风险。详见说明书。
【用法用量】非奈利酮的目标剂量为20 mg,每日一次。根据eGFR以确定非奈利酮的推荐起始剂量,如果血清钾>5.0 mmol/L,请勿开始治疗。在开始治疗后4周内、剂量调整后4周内和整个治疗期间监测血清钾,基于血清钾浓度和当前剂量进行剂量调整。详见说明书。
【不良反应】非奈利酮治疗期间最常报告的不良反应为高钾血症(14.0%),其他常见不良反应有低钠血症、低血压、瘙痒、肾小球滤过率降低等。详见说明书。
【禁忌】对活性成份或任何辅料过敏。?与CYP3A4强效抑制剂联合用药,例如伊曲康唑、酮康唑、利托那韦、奈非那韦、考比司他、克拉霉素、泰利霉素、奈法唑酮等。 患有Addison氏病。
【注意事项】1. 在接受本品治疗的患者中观察到高钾血症。须考虑对高钾血症风险较高的患者,如低eGFR水平、高血清钾水平及既往发生过高钾血症等,进行更频繁的监测;与可能升高血清钾的药物联合用药会增加高钾血症的风险;高钾血症的风险随着肾功能的降低而增加。2. 由于临床数据有限,不应在eGFR<25 mL/min/1.73 m2的患者中开始本品治疗,进展至终末期肾病(eGFR<15 mL/min/1.73 m2)的患者应停止本品治疗。3. 重度肝功能损害患者不应开始本品治疗,可能需要对使用本品的中度肝功能损害患者进行额外的监测。4. 在本品与CYP3A4中效或弱效抑制剂联合使用期间,应监测血清钾;不应与CYP3A4强效或中效诱导剂联合使用;不应食用葡萄柚或饮用葡萄柚汁。5. 本品处方中含乳糖,患有罕见的遗传性半乳糖不耐受、乳糖酶缺乏症或葡萄糖-半乳糖吸收不良症的患者不应使用本品。详见说明书。
【药物分类】处方药
【药品上市许可持有人】名称:Bayer AG
注册地址:51368 Leverkusen, Germany
【生产企业】企业名称:Bayer AG
生产地址:Kaiser-Wilhelm-Allee, 51368 Leverkusen, Germany
【说明书版本】核准日期:2022年06月28日
修改日期:2023年05月12日
关于本产品完整的处方信息请参阅产品说明书
非奈利酮作为一种新型非甾体盐皮质激素受体拮抗剂(ns-MRA),通过全面阻断盐皮质激素受体(MR)过度激活,强效精准阻断炎症与纤维化进程,直接全面保护心肾靶器官,现已成为T2DM相关CKD的一线治疗药物并广泛应用于临床。然而,影响其治疗中断的因素及中断治疗对心肾预后的影响仍需进一步研究。
在2025年世界肾脏病学大会(WCN 2025)上,一项FIDELITY事后分析结果发布[1],该研究探讨了非奈利酮治疗提前中断的预测因素,并评估了其治疗中断对T2DM相关CKD患者肾脏和心血管结局的影响。本刊特邀四川大学华西医院付平教授对此进行点评,以期为非奈利酮的临床实践优化提供重要见解。
研究设计与方法
FIDELITY研究是对FIDELIO-DKD和FIGARO-DKD两项Ⅲ试验的汇总分析,涵盖了G1-G4期广泛T2DM相关CKD患者。该研究是基于FIDELITY研究的预设汇总分析,共纳入了12 990例患者,随机接受非奈利酮或安慰剂治疗(1:1),中位随访时间为3年。
该研究评估了非奈利酮治疗中断的预测因素,以及非奈利酮治疗中断后对肾脏复合结局及心血管复合结局的影响(肾脏复合结局定义为肾脏衰竭、eGFR持续下降≥57%或肾脏相关死亡;心血管复合结局定义为心血管死亡、非致死性心肌梗死、非致死性卒中或因心力衰竭住院)。研究设计、FIDELIO-DKD和FIGARO-DKD的关键入选标准以及FIDELITY事后分析中评估的关键结局如图1所示。

图1. 研究设计、关键入选标准以及主要研究终点
统计分析
1.基线人口统计学特征、治疗中断原因及疗效结局分析:该分析纳入了所有随机化参与者,但排除了严重违反药品临床试验管理范(GCP)的个体。
2.治疗中断预测因素的识别与评估:在安全性分析集中进行,该集包括至少服用过一剂研究药物且未严重违反GCP的随机化参与者。
3.预测因素的选择:基于临床相关因素和单变量Cox模型观察到的差异,选择基线特征作为治疗中断的潜在预测因素。采用基于Akaike信息准则的自动变量选择方法,通过多变量Cox比例风险模型分析确定的预测因素。
4.治疗中断对疗效结局的影响:使用分层Cox模型评估,将治疗中断作为时间依赖性协变量。
5.治疗效果的表达:Cox比例风险模型得出的治疗效果以风险比(HR)及其95%置信区间(CI)表示。
6.分析软件:所有分析均使用SAS软件(版本9.4,SAS Institute Inc.)完成。
研究结果
参与者基线特征
在全分析集的12 990名参与者中,2889名(22.2%)因非死亡原因提前中断治疗(非奈利酮组:22.8%;安慰剂组:21.6%),10 101名(77.8%)继续治疗(非奈利酮组:77.2%;安慰剂组:78.4%)。两组间的基线特征和药物使用情况总体平衡,但提前中断治疗的参与者与未中断治疗的参与者在某些关键特征上存在差异。
提前中断治疗的原因
两组中提前中断研究药物治疗的主要原因均为不良事件的发生(非奈利酮组:9.0%;安慰剂组:8.7%)(表1)。非奈利酮组因治疗相关不良事件导致药物中断的发生率略高于安慰剂组(非奈利酮组:6.4%;安慰剂组:5.4%)。因高钾血症导致治疗中断的比例在两组中均较低(非奈利酮组:1.7%;安慰剂组:0.6%)。
表1. 各治疗组提前停止研究药物的主要原因

治疗中断的预测因素
在非奈利酮组中,年龄较大、黑人和白人种族(相对于亚洲人)、较低的eGFR、较高的UACR和较高的血清钾水平与治疗中断风险增加相关(图2)。交互分析显示,非奈利酮组和安慰剂组在基线特征对治疗中断的影响方面未发现显著异质性。

图2. 多变量Cox模型评估非奈利酮组提前中断治疗的预测因素
非奈利酮治疗中断对肾脏以及心血管复合结局的影响
与治疗期间相比,非奈利酮对复合肾脏结局的治疗效果在治疗中断后有所减弱(HR=0.82;95%CI:0.66~1.02),而治疗期间为HR=0.65;95%CI:0.54~0.78;P=0.0959)。对于复合心血管结局,非奈利酮的治疗效果在治疗中断后也有所下降(HR=0.93;95%CI 0.79~1.09),而治疗期间为HR=0.79;95%CI:0.70~0.88;P=0.0960)(图3)。该结果提示提前中断治疗可使非奈利酮对肾脏和心血管结局的积极作用减弱。

图3. 非奈利酮提前中断治疗对肾脏和心血管复合结局的影响
研究结论
总体而言,非奈利酮组的中断治疗率较低,与安慰剂相当,不良反应的发生是最常见的原因,且两组因高钾血症而中断治疗的比例均较低。中断治疗风险随着年龄增长、黑人和白人种族、较低的eGFR、较高的UACR和较高的血钾水平而增加,并未发现这些风险因素在非奈利酮组和安慰剂组之间有显著差异。需要强调的是,非奈利酮持续治疗的心肾获益优于中断治疗。
专家点评

非奈利酮早期起始,20 mg标准剂量持续治疗以最大化心肾获益
炎症和纤维化是T2DM相关CKD发生和进展的核心驱动因素,早期炎症和纤维化指标的升高与心肾不良事件及死亡风险显著相关。因此,早期启动抗炎和抗纤维化干预至关重要。传统药物如RASi和SGLT2i主要通过调节血流动力学和代谢途径发挥作用,无法直接、全面地抑制炎症和纤维化进程[2-6]。非奈利酮填补了靶向炎症和纤维化治疗的空白。
非奈利酮是全球首个获批用于T2DM相关CKD治疗的新型ns-MRA,与RASi/SGLT2i相比,非奈利酮通过靶向精准抗炎抗纤维化,直接全面保护心肾靶器官,直击疾病本质。同时,其作用位点分布较RASi/SGLT2i更广泛,能够更直接、全面地发挥心肾保护作用。III期临床研究FIDELIO-DKD、FIGARO-DKD及FIDELITY证实,非奈利酮显著降低T2DM相关CKD患者的心肾事件风险,奠定了其作为一线标准治疗的地位[7-9]。在中国人群中,非奈利酮展现出更显著的肾脏获益和多维心血管获益,显著降低蛋白尿,尤其适合中国患者。
这项FIDELITY事后分析结果强调了非奈利酮早期起始,持续治疗对于最大化非奈利酮的临床效益至关重要。为实现最大化非奈利酮的临床价值,对非奈利酮的临床使用建议如下:
早期起始治疗
我国T2DM和CKD患者基数庞大,且早期(G1-G2期)患者占比高达73.3%[10],为早期干预提供了重要机会。对于G1-G2期患者,尽管肾功能尚可,但CV风险已经显著升高,因此,G1-G2期患者应加强对CV风险的早期干预。FIGARO-DKD研究表明,早期启用非奈利酮可显著降低心血管复合终点风险13%,新发心衰风险32%[8]。
随着疾病进展,CKD患者可能面临更高的不良事件风险,容易错失最佳治疗时机。与G3-G4人群相比,G1-G2期患者使用非奈利酮的高钾血症发生率更低,耐受性更好。FINE-REAL中期分析显示,中国真实世界中,非奈利酮起始患者中G1-G2期占比45%,总体耐受性良好,高钾血症发生率低[11-12]。该研究也表明,eGFR>60 ml/min/1.73m2的患者起始非奈利酮治疗有利于减少非奈利酮治疗中断的风险,提高患者的依从性,最大化患者的肾心获益。
20 mg标准剂量使用
ARTS-DN研究和FIDELIO-PK/PD模型证实,非奈利酮的疗效与剂量呈显著正相关[13-14]。III期研究中,非奈利酮平均剂量为15.1 mg(FIDELIO-DKD)和17.5mg(FIGARO-DKD),推荐20 mg标准剂量长期治疗以最大化获益[7-8]。
长期治疗,持续获益
T2DM相关CKD患者治疗应以改善心肾结局为目标。非奈利酮不仅显著降低蛋白尿,更能通过靶向抗炎抗纤维化提供持续的心肾靶器官保护。既往研究表明,非奈利酮停药后1个月,UACR显著增高,重启非奈利酮治疗后UACR显著下降[13]。该研究也表明,非奈利酮中断治疗后心肾保护作用减弱[1]。因此,在临床实践中,不能将非奈利酮仅作为降低“蛋白尿”的药物,长期治疗是最大化非奈利酮临床价值的关键。
总结
T2DM相关CKD是一种慢性进展性疾病,若未得到充分治疗,可能引发终末期肾病(ESRD)和心力衰竭(HF),因为肾脏损伤与心血管(CV)并发症通过共同的病理生理机制相互影响,因此,心肾靶器官保护应贯穿疾病管理的全程。非奈利酮作为权威指南推荐的一线标准治疗药物,通过靶向精准抑制炎症和纤维化进程,显著降低T2DM相关CKD患者肾脏和心血管事件风险。最新FIDELITY事后分析表明,非奈利酮早期起始、使用20mg标准剂量持续治疗,可有效提高患者依从性,减少治疗中断风险,最大化长期心肾的保护作用。
付平 教授
四川大学华西医院
二级教授/主任医师,博士/博士后合作导师
四川大学华西医院肾脏内科主任/华西肾脏病研究所所长
国际肾脏病学者(ISN Scholar),《中华医学杂志英文版》等23种杂志编委
国家重点研发计划等27项课题负责人
以第一作者和通讯作者发表论文400余篇,其中SCI收录150余篇,包括JASN,Cell research,STTT等国际著名期刊
主编人民卫生出版教材和专著各一部
中华医学会科技进步二等奖,华夏医学科技进步二等奖及四川省科技进步一等奖各一项
国家发明及实用新技术专利31项,转化6项,其中一项2016年进国家基本医保目录,软著7项,转化5项
中华医学会肾脏病学分会8.9.10届常委
中国医师协会肾脏内科分会常委
中国医院协会血液净化中心分会副主任委员
中国中药协会肾病中药发展研究专委会主任委员
世界华人肾脏医师协会副会长
中国药理学会肾脏药理专委会常委
四川省医学会肾脏病专委会主任委员
四川省医师协会肾脏内科医师分会会长
四川省国际医学交流促进会肾脏分会会长
参考文献
1.Anker S, et al. WCN25-288#EFFECT OF FINERENONE TREATMENT DISCONTINUATION ON KIDNEY AND CV OUTCOMES IN PATIENTS WITH CKD AND T2D: A FIDELITY SUBANALYSIS. Kidney International Reports. 2025; 10: S1-S773.
2.Bomback AS, et al. Nat Clin Pract Nephrol. 2007 Sep,3(9):486-922.
3.Bauersachs J,et al.Hypertension.2015 Feb:65(2):257-63.2
4.Dong H,et al Signal Transduct Target Ther 2024 Feb 28:9(1).38
5.FolzR,Laiteerapong N,Diabetologia.2021 0ct64(10)2131-21375.
6.Ceriello A,et al. Lancet Reg Health Eur. 2023 Jun 12.31:100666.
7.Bakris GL, et al. N Engl J Med. 2020; 383(23): 2219-2229.
8.Pitt B, et al. N Engl J Med. 2021; 385(24): 2252-2263.
9.Agarwal R, et al. Eur Heart J. 2022 Feb 10;43(6):474-484.
10.DALONG ZHU, et al. 1373-P: The Prevalence and Risk Factors of Chronic Kidney Disease in Patients with Type 2 Diabetes in China—A Cross-Sectional Study. 2023 ADA.
11.Bayer. https://clinicaltrials.gov/study/NCT05703880 [accessed 5 Apr 2024].
12.Kovesdy C, et al. ERA 2024; poster (abstract 2022).
13.Bakris GL, et al. JAMA 2015; 314: 884-894.
14. Goulooze SC, et al. Clin Pharmacokinet. 2022; 61(7): 1013-1025.
审批号:PP-KER-CN-1133-1
仅供与医疗卫生专业人士学术沟通使用
非奈利酮说明书.可申达®(非奈利酮片)简明处方信息:
【药品名称】通用名称: 非奈利酮片 商品名称: 可申达?(Kerendia?)
【成份】本品主要成份为非奈利酮
【适应症】本品用于与2型糖尿病相关的慢性肾脏病成人患者(伴白蛋白尿),以降低eGFR持续下降、终末期肾病、心血管死亡和因心力衰竭住院的风险。详见说明书。
【用法用量】非奈利酮的目标剂量为20 mg,每日一次。根据eGFR以确定非奈利酮的推荐起始剂量,如果血清钾>5.0 mmol/L,请勿开始治疗。在开始治疗后4周内、剂量调整后4周内和整个治疗期间监测血清钾,基于血清钾浓度和当前剂量进行剂量调整。详见说明书。
【不良反应】非奈利酮治疗期间最常报告的不良反应为高钾血症(14.0%),其他常见不良反应有低钠血症、低血压、瘙痒、肾小球滤过率降低等。详见说明书。
【禁忌】对活性成份或任何辅料过敏。?与CYP3A4强效抑制剂联合用药,例如伊曲康唑、酮康唑、利托那韦、奈非那韦、考比司他、克拉霉素、泰利霉素、奈法唑酮等。 患有Addison氏病。
【注意事项】1. 在接受本品治疗的患者中观察到高钾血症。须考虑对高钾血症风险较高的患者,如低eGFR水平、高血清钾水平及既往发生过高钾血症等,进行更频繁的监测;与可能升高血清钾的药物联合用药会增加高钾血症的风险;高钾血症的风险随着肾功能的降低而增加。2. 由于临床数据有限,不应在eGFR<25 mL/min/1.73 m2的患者中开始本品治疗,进展至终末期肾病(eGFR<15 mL/min/1.73 m2)的患者应停止本品治疗。3. 重度肝功能损害患者不应开始本品治疗,可能需要对使用本品的中度肝功能损害患者进行额外的监测。4. 在本品与CYP3A4中效或弱效抑制剂联合使用期间,应监测血清钾;不应与CYP3A4强效或中效诱导剂联合使用;不应食用葡萄柚或饮用葡萄柚汁。5. 本品处方中含乳糖,患有罕见的遗传性半乳糖不耐受、乳糖酶缺乏症或葡萄糖-半乳糖吸收不良症的患者不应使用本品。详见说明书。
【药物分类】处方药
【药品上市许可持有人】名称:Bayer AG
注册地址:51368 Leverkusen, Germany
【生产企业】企业名称:Bayer AG
生产地址:Kaiser-Wilhelm-Allee, 51368 Leverkusen, Germany
【说明书版本】核准日期:2022年06月28日
修改日期:2023年05月12日
关于本产品完整的处方信息请参阅产品说明书
- 推荐文章
IgA肾病当前的诊断困境及生物标志物的研究进展
传统 vs. 新型盐皮质激素拮抗剂:谁在护心伤肾?——基于近3万例患者的肾脏安全性大揭秘
患者小课堂|你、我、他,谁更容易患肾脏病?一文速览
病例分享 | 20多岁冶金厂年轻小伙子咳嗽咯血,居然是这种罕见且凶险的肾病在捣乱!
氟氢可的松治疗成功纠正他克莫司诱导的低钠血症病例
世界睡眠日特别提醒!如何应对CKD患者的睡眠障碍
跟随国际IgA肾病联盟主席Jonathan Barratt教授,了解IgA肾病治疗最新进展——WCN 2025回顾
急性肾盂肾炎前瞻观察:哪些因素左右患者出院后的肾脏结局?
紧跟指南,护肾趁早!T2DM相关CKD治疗须与时俱进
肾域华章丨中大一院肾内科研究揭示IgA肾病伴肾病综合征患者的临床病理特征及与预后的关系
容易纠缠不清的病魔!泌尿系感染之肾盂肾炎,不容小觑
APRIL在IgA肾病治疗中的潜力
中国国医节 | 传承与创新:中西合璧挑战狼疮肾炎——黄芪的作用
蛋白尿与年轻人心搏骤停相关——CKD较严重者,风险更高
JASN|补体抑制剂治疗IgA肾病有望实现两个月给药一次?国际IgA肾病领军者Barratt教授最新研究揭晓
病例分享|不期而遇的困扰!丙肝患者短期内出现尿量减少,肌酐升高,警惕罕见的冷球蛋白血症肾病
2025年世界肾脏日:您的肾脏还好吗?早检查=保健康
ADPKD患者肾功能越差,疼痛频率越高,对睡眠的影响越显著
前沿进展|ORIGIN 2期研究结果重磅揭晓:阿塞西普长期治疗IgA肾病有效且安全
患者小课题|别让糖尿病伤了肾——如何早期发现糖尿病肾病
世界肾脏日丨早检查,保健康,拉紧心肾损伤警报线,优化T2DM相关CKD管理策略
Nature子刊|一文全解狼疮性肾炎相关CKD的管理理念与未来研究方向
狼疮性肾炎:突破传统,探索治疗新前沿
IgA肾病:IgA1免疫复合物的面面观
两款药物即将上市!FDA批准呋塞米注射液用于治疗CKD水肿;接受Obinutuzumab治疗狼疮肾炎的补充许可申请
慢性肾脏病患者的“症状关卡”,如何巧妙通关?
“心”感染,“肾”也跟着坏掉?感染性心内膜炎相关性肾炎,究竟是怎么一回事儿?
CKD相关心肌病的早期诊断与规范治疗
睡眠质量差,血液透析患者的“隐形杀手”!
WCN中国之声 | 郝传明教授:低氧诱导因子脯氨酰羟化酶抑制剂在慢性肾脏病贫血治疗中的两面性
探索替尔泊肽在肾脏疾病中的双重激动作用:GLP-1激动剂与潜在GIP介导的获益
什么是CKD相关心肌病?
IgA肾病的新兴疗法与当前争议
警惕!应用噻嗪类利尿剂后出现早期低钠血症,死亡风险或将大幅攀升!
高强度间歇训练显著降低老年人肾功能快速下降风险
指南共识 | 2024 ACR狼疮肾炎诊疗指南更新解读:从序贯治疗到联合免疫靶向的范式转变
病例分享丨中年男子3个月内肾功能快速恶化,原因究竟为何般?这种临床危重症,值得警惕
前沿进展丨常染色体显性多囊肾病患者的肾脏非线性生长模式与不良预后密切相关
糖衣炮弹下的肾脏危机!糖尿病最常见、最严重的并发症之一——糖尿病肾脏疾病
患者小课堂| IgA 肾病:症状背后的真相与应对策略
NEJM丨伊普可泮治疗IgA肾病Ⅲ期临床研究APPLAUSE-IgAN结果揭晓
狼疮性肾炎:流行病学特征与发病机制的最新研究进展
Kidney360|从成像模式看中国ADPKD患者临床特征及肾脏结局走向
NDT丨蛋白尿还是白蛋白尿?IgA肾病风险预测的关键指标再评估
WCN 2025|非奈利酮早期起始,持续治疗对于最大化患者临床效益至关重要
对激素(全身或肠道释放型布地奈德)耐药的肾病综合征范围蛋白尿的IgA肾病:他克莫司能否作为替代药物?
WCN 2025|非奈利酮显著降低蛋白尿,且疗效与安全性不受肾切除术史影响
病例分享 | 血透老人多病共存,内环境如同“纸糊“!棘手局面,肾病科医师如何破局?
WCN 2025|非奈利酮在肾移植后患者中安全有效,值得进一步探索
患者小课堂丨肾虚、肾亏是慢性肾炎吗?
NEJM前沿速递|阿曲生坦治疗IgA肾病Ⅲ期ALIGN试验的中期分析结果正式见刊
微小病变肾病,肾病综合征的第三大原因!“微小”病变也不容忽视,及时准确诊疗很关键
奥妥珠单抗有效保护LN患者的肾功能,显著减少LN发作,还具有减少糖皮质激素使用的潜力:NOBILITY试验事后分析
CKJ|浆细胞与补体或许是MN的潜在治疗靶点
揭秘BAFF、APRIL在IgA肾病中的作用以及治疗研究进展
