- 首页 > 正文
CKD相关心肌病的早期诊断与规范治疗
发表时间:2025-05-23 16:32:03
编者按:前文我们对CKD相关心肌病的危险因素、发病机制及相关表现进行了详细介绍(点击阅读:什么是CKD相关心肌病?),本文结合《慢性肾脏病相关心肌病综合管理中国专家共识(2024版)》[1](以下简称“共识”)重点介绍如何对CKD相关心肌病进行早期诊断和规范治疗,期望帮助相关医疗工作者更好地应对这一挑战,最终提高患者的疗效和生活质量。
一、CKD相关心肌病的诊断与筛查
共识[1]推荐:
建议对有心脏特异性症状和/或CKD G3b以后的CKD患者启动诊断流程并常规筛查是否患有CKD相关心肌病。
在CKD G3b以后患者每6~12月检测1次血清标志物,如血浆N-末端脑钠肽前体(NT-proBNP)水平等,如果NT-proBNP>125 pg/ml,则应进行经胸超声心动图检查。
CKD G1~3a患者应该每12~24月进行1次心电图及经胸超声心动图检查;CKD G3b以后,患者应该每6~12月进行1次心电图及经胸超声心动图检查。
在CKD G3b以后,有条件的患者可进行1次心脏磁共振成像(CMR)检查。
荐CKD伴高血压患者应该每6~12月行24小时动态血压监测来准确诊断血压控制不足。
二、CKD相关心肌病的治疗
01透析治疗与患者获益
研究表明,较长时间、频繁进行的“强化”透析方案与降低LVM、降低LVH的发生率以及减少住院次数相关(图1)。目前尚不清楚降低LVM是否与透析治疗直接相关,例如清除尿毒症毒素、更好地控制磷和血红蛋白,或改善血压控制。尽管强化透析具有明显的健康和生活质量益处,但仍需要考虑增加患者和护理负担、感染、残余肾功能丧失和血管通路并发症的潜在风险[2~4]。
共识推荐[1]:
建议对于CKD相关心肌病患者,肾功能进展至CKD G5且出现有症状的HF时,作为开始透析的指征之一。
推荐对于CKD相关心肌病 CKD G5D患者如行血液透析,应该优化透析模式,如选择高通量血液透析(high flux hemodialysis,HFHD)、在线血液透析滤过(online hemodiafiltration,OL-HDF);如有条件可采用短时每日血液透析(short daily hemodialysis,SDHD)或长时、频繁的“强化”透析方案。
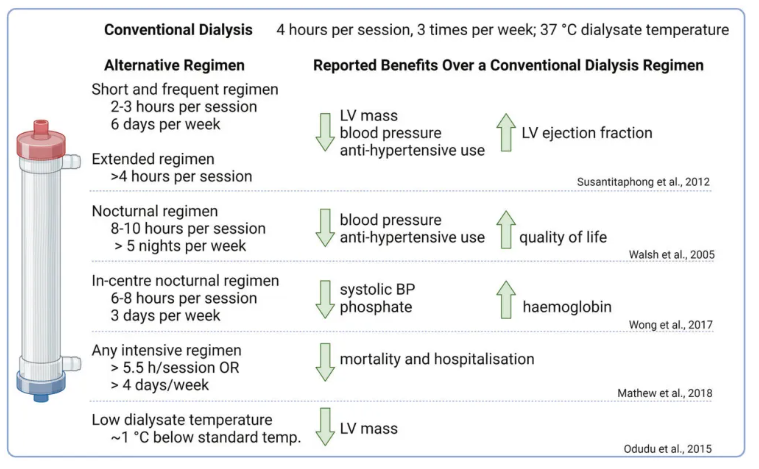
图1. 透析方案对血压、心脏等预后的影响
02肾移植与患者获益
有研究报道肾移植可以改善肾功能,减少LVM,改善心脏的舒张和收缩功能,并有可能逆转心肌纤维化,从而降低心血管风险。然而,移植后使用的免疫抑制剂可能对心脏产生毒性作用。尽管这些研究认为肾移植后LVM的显著降低,但随机对照组较少,容易产生偏倚[5,6]。《心肾综合征诊疗的临床实践指南(2023版)》推荐:肾移植增加心血管事件和HF风险,移植前严重心功能障碍增加肾移植患者死亡风险;不建议合并NYHA Ⅲ/Ⅳ级或LVEF≤40%的心肾综合征患者实施单独肾移植。对于GFR<30 ml/(min·1.73m2)且合并终末期HF的心肾综合征患者,建议实施心肾联合移植。
03血压管理与患者获益
(1)透析前血压靶目标值
共识推荐了CKD相关心肌病合并高血压的血液透析患者透析前血压靶目标值,对于年龄<60岁者,血压为<140/90 mmHg;年龄≥60 岁者,血压为<160/90 mmHg;透析后血压≥120/70 mmHg;建议腹膜透析患者持续控制血压<140/90 mmHg[1]。
(2)降压治疗对LVH的影响
降压治疗可以有效减少LVH并降低相关的心血管事件风险。研究表明,血管紧张素转换酶抑制剂(ACEI)和血管紧张素受体阻滞剂(ARB)、钙通道阻滞剂和利尿剂在内等抗高血压药物能够减轻LVH。其中,ACEI和ARBs在减轻LVH方面比β受体阻滞剂更有效。此外,多项研究指出,一些特定的利尿剂(包括氯噻酮、吲达帕胺和钾保利尿剂/氢氯噻嗪)在降低LVM方面比ACE抑制剂、ARBs以及氢氯噻嗪更有效[2,7,8]。
(3)CKD相关心肌病高血压患者的药物选择及注意事项
“优先使用的”降压药物是指除了降低血压外,还通过其他机制降低CVD风险或延缓CKD进展(图2)。共识推荐[1]:
为了达到治疗的目标,通常需要联合使用多种药物。初始降压治疗应包括一种ACEI或ARB,单独或联合其他降压药,但不建议ACEI和ARB联合应用。
合并射血分数降低的HF(HFrEF):首选血管紧张素受体-脑啡肽酶抑制剂(ARNI)、ACEI/ARB、β受体阻滞剂和醛固酮受体拮抗剂。如仍未能控制高血压,推荐钙离子通道阻滞剂。
合并射血分数保留的HF(HFpEF):虽然暂无证据表明ACEI/ARB、β受体阻滞剂和醛固酮受体拮抗剂可降低此类患者的死亡率和改善预后,但用于降压治疗仍值得推荐,如仍未能控制高血压,推荐应用钙离子通道阻滞剂。
在CKD G3及以上的患者使用ACEI或ARB时,初始剂量可减半,严密监测血钾和血肌酐水平以及eGFR,并及时调整药物剂量和剂型。
对于非透析依赖CKD和尚有残余肾功能的CKD G5D患者,推荐在容量负荷过重的CKD相关心肌病患者应用利尿剂(噻嗪类、袢利尿剂和保钾利尿剂),同时应该监测容量状况和电解质。
推荐CKD相关心肌病患者应该早期使用改善心肌重构、抑制心肌纤维化、炎症和氧化应激,控制HF症状、改善心血管结局的药物。
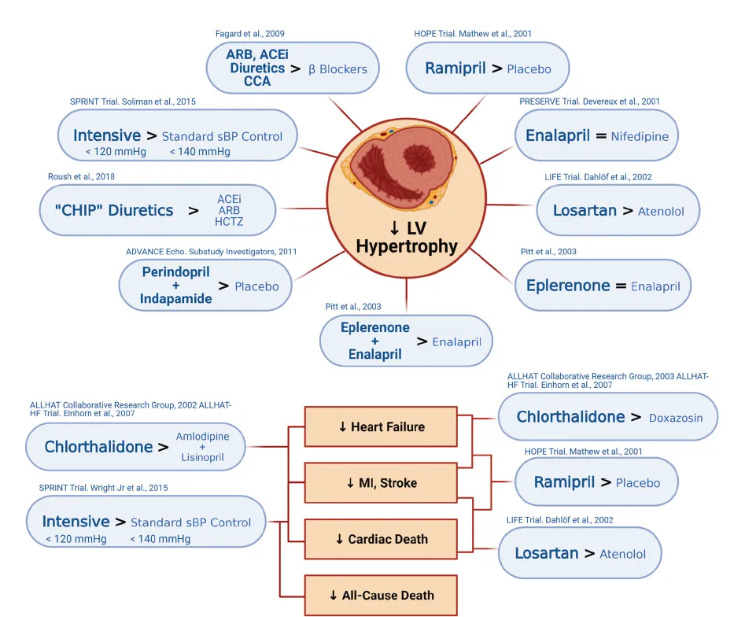
图2. 比较常规降压治疗对心脏的影响
04新型药物在CKD相关心肌病中的应用
ARNI
ARNI是由脑啡肽酶抑制剂和血管紧张素受体阻滞剂组成的共晶复合物(如沙库巴曲缬沙坦)。它可以有效抑制脑啡肽酶,增强利钠肽系统的有益作用,并阻断血管紧张素Ⅱ-1受体,从而协同发挥舒张血管、预防和逆转心血管重构和促尿钠排泄等作用。多项随机对照研究证实了ARNI的降压疗效,且相较于依那普利,ARNI可快速逆转心脏重构。沙库巴曲缬沙坦在透析人群中可改善心脏结构及功能[9,10]。美国心脏病学会(ACC)/美国心脏协会(AHA)和美国心力衰竭学会(HFSA)建议在慢性症状性HFrEF患者中使用ACEI、ARB或ARNI,以降低发病率和死亡率。2022年AHA/ACC/HFSA心力衰竭管理指南及中国心力衰竭诊断和治疗指南(2024)均建议使用ARNI来治疗HFpEF的HF患者。
MRA
盐皮质激素受体拮抗剂(MRA)可以减轻左心室肥厚、改善慢性HF、抑制血管纤维化和硬化,以及减少炎症。在CKD患者中,螺内酯可以降低CKD患者LVM,改善动脉硬化,并且这种效果可能独立于血压控制。尽管如此,对于接受透析的患者,MRA的益处与风险仍存在不确定性。一项Cochrane荟萃分析发现,使用MRA可能与降低全因和心血管死亡风险相关[11]。
SGLT2i
钠-葡萄糖协同转运体(SGLT2i)抑制剂对糖尿病患者和非糖尿病患者都有益,可降低心脏负荷,改善内皮功能和血管张力,增强心肌收缩力,并可能保护心脏。研究指出,这些药物能改善心肌功能,促进自噬,减少炎症和氧化应激,阻止心肌纤维化,并有助于逆转心室重构。例如,恩格列净和达格列净可以减少左室质量,并带来其他心脏益处[2]。
05其他综合管理措施
(1)贫血的管理
共识[1]指出:
对于CKD相关心肌病患者,推荐血红蛋白(Hb)的目标值维持在110~120 g/L。
对于CKD相关心肌病患者,建议在Hb<100 g/L时开始使用红细胞生成刺激剂(ESAs),前提是转铁蛋白饱和度(TSAT)>20%且铁蛋白>200 ng/ml;如合并难以控制的高血压和/或Hb≥90 g/L且合并HF则不推荐ESAs。
对于CKD相关心肌病患者,建议在Hb<100 g/L时可以应用低氧诱导因子脯氨酰羟化酶抑制剂( HIF-PHI)纠正贫血。
对于CKD相关心肌病合并贫血的患者,如TSAT≤20%且铁蛋白≤200 ng/ml,推荐补充铁剂。特别是合并有症状的慢性HF患者,应该每年通过测量血清铁蛋白和TSAT评估是否存在铁缺乏。补铁3个月后,应重新评估铁状态,并根据需要提供进一步补充。
推荐CKD相关心肌病合并慢性HF患者,补充铁剂治疗时,以静脉补铁为佳,如羧基麦芽糖铁或异麦芽糖酐铁,以改善HF症状、改善运动耐量及生活质量,并减少再住院。
(2)CKD-MBD的管理
CKD-MBD与多种因素相关,包括FGF-23升高、Klotho减少、PTH和维生素D紊乱,导致钙、磷代谢紊乱,增加心血管疾病和死亡风险。FGF-23水平升高是CKD相关心肌病的主要原因,能直接导致心脏肥大。拟钙剂能减少FGF-23水平,降低PTH水平,改善心脏功能。维生素D是CKD-MBD的重要因素,与矿物质代谢控制和心血管健康相关。减少磷摄入、补充钙和维生素D可降低血磷,升高血钙,改善PTH分泌,防治心血管钙化和心肌纤维化。对于严重甲状旁腺功能亢进和药物治疗无效的患者,建议甲状旁腺切除术[2]。
共识[1]推荐:
对于CKD相关心肌病患者,推荐早期纠正钙磷代谢紊乱,积极治疗继发性甲状旁腺功能亢进症。
推荐对eGFR<60 ml/(min·1.73m2)的CKD患者监测CKD-MBD指标,定期监测血清钙、磷、甲状旁腺激素(PTH)以及维生素D水平,并定期评估心血管钙化。
推荐对于持续性高PTH或PTH进行性升高的患者,应评估是否存在可改善的因素,如高磷血症、高磷摄入、低钙血症及维生素D缺乏,并及时纠正。
(3)体重的管理[1]
共识[1]指出:
推荐对于超重的CKD患者应当均衡饮食,将体质量指数(BMI)保持在合适范围(<2 5 kg/m2)。
建议CKD相关心肌病患者限制饮食中钠的摄入<3 g/d(食盐摄入量<6 g/d),其中维持性血液透析患者建议限制饮食中钠的摄入<2 g/d。
建议所有CKD患者(包括透析患者)保持积极的生活方式,在专业指导下运动康复。
总结
CKD相关心肌病的病理生理机制复杂,多种CKD并发症如容量负荷过高、高血压、贫血、CKD-MBD等互相作用,这给患者的诊断和管理带来了极大的挑战。目前,通过有效的血压控制来逆转LVH是可行的,但其效果是否独立于血压控制还需要进一步的验证,需要进一步的研究来确定CKD患者中LVH的逆转与预后改善之间的关系。对于不同的高血压目标人群,包括非肾病、肾病非透析和透析依赖患者,需要寻找更适合他们的血压目标值和药物。
参考文献
[1] 中国血液净化. 2024年8月, 第23卷, 第8期: 561-580.
[2] Journal of Human Hypertension (2023) 37:1–19.
[3] Canadian Journal of Kidney Health 2018; 5: 1-18
[4] N Engl J Med 2023;389:700-9.
[5] ESC Heart Failure2021;8: 2045–2057
[6] Journal of Cardiovascular Magnetic Resonance (2019) 21:21
[7] Am J Med. 2003;115:41–46.
[8] Hypertension. 2009;54:1084-1091.
[9] N Engl J Med 2014;371:993-1004.
[10] J Cardiol . 2019 Oct;74(4):372-380
[11] N Engl J Med 2021;385:2252-63.
[12] Am J Hypertens. 2014 Feb;27(2):146-56
[13] Am J Kidney Dis. 2016;68(4):554-563
一、CKD相关心肌病的诊断与筛查
共识[1]推荐:
建议对有心脏特异性症状和/或CKD G3b以后的CKD患者启动诊断流程并常规筛查是否患有CKD相关心肌病。
在CKD G3b以后患者每6~12月检测1次血清标志物,如血浆N-末端脑钠肽前体(NT-proBNP)水平等,如果NT-proBNP>125 pg/ml,则应进行经胸超声心动图检查。
CKD G1~3a患者应该每12~24月进行1次心电图及经胸超声心动图检查;CKD G3b以后,患者应该每6~12月进行1次心电图及经胸超声心动图检查。
在CKD G3b以后,有条件的患者可进行1次心脏磁共振成像(CMR)检查。
荐CKD伴高血压患者应该每6~12月行24小时动态血压监测来准确诊断血压控制不足。
二、CKD相关心肌病的治疗
01透析治疗与患者获益
研究表明,较长时间、频繁进行的“强化”透析方案与降低LVM、降低LVH的发生率以及减少住院次数相关(图1)。目前尚不清楚降低LVM是否与透析治疗直接相关,例如清除尿毒症毒素、更好地控制磷和血红蛋白,或改善血压控制。尽管强化透析具有明显的健康和生活质量益处,但仍需要考虑增加患者和护理负担、感染、残余肾功能丧失和血管通路并发症的潜在风险[2~4]。
共识推荐[1]:
建议对于CKD相关心肌病患者,肾功能进展至CKD G5且出现有症状的HF时,作为开始透析的指征之一。
推荐对于CKD相关心肌病 CKD G5D患者如行血液透析,应该优化透析模式,如选择高通量血液透析(high flux hemodialysis,HFHD)、在线血液透析滤过(online hemodiafiltration,OL-HDF);如有条件可采用短时每日血液透析(short daily hemodialysis,SDHD)或长时、频繁的“强化”透析方案。

图1. 透析方案对血压、心脏等预后的影响
02肾移植与患者获益
有研究报道肾移植可以改善肾功能,减少LVM,改善心脏的舒张和收缩功能,并有可能逆转心肌纤维化,从而降低心血管风险。然而,移植后使用的免疫抑制剂可能对心脏产生毒性作用。尽管这些研究认为肾移植后LVM的显著降低,但随机对照组较少,容易产生偏倚[5,6]。《心肾综合征诊疗的临床实践指南(2023版)》推荐:肾移植增加心血管事件和HF风险,移植前严重心功能障碍增加肾移植患者死亡风险;不建议合并NYHA Ⅲ/Ⅳ级或LVEF≤40%的心肾综合征患者实施单独肾移植。对于GFR<30 ml/(min·1.73m2)且合并终末期HF的心肾综合征患者,建议实施心肾联合移植。
03血压管理与患者获益
(1)透析前血压靶目标值
共识推荐了CKD相关心肌病合并高血压的血液透析患者透析前血压靶目标值,对于年龄<60岁者,血压为<140/90 mmHg;年龄≥60 岁者,血压为<160/90 mmHg;透析后血压≥120/70 mmHg;建议腹膜透析患者持续控制血压<140/90 mmHg[1]。
(2)降压治疗对LVH的影响
降压治疗可以有效减少LVH并降低相关的心血管事件风险。研究表明,血管紧张素转换酶抑制剂(ACEI)和血管紧张素受体阻滞剂(ARB)、钙通道阻滞剂和利尿剂在内等抗高血压药物能够减轻LVH。其中,ACEI和ARBs在减轻LVH方面比β受体阻滞剂更有效。此外,多项研究指出,一些特定的利尿剂(包括氯噻酮、吲达帕胺和钾保利尿剂/氢氯噻嗪)在降低LVM方面比ACE抑制剂、ARBs以及氢氯噻嗪更有效[2,7,8]。
(3)CKD相关心肌病高血压患者的药物选择及注意事项
“优先使用的”降压药物是指除了降低血压外,还通过其他机制降低CVD风险或延缓CKD进展(图2)。共识推荐[1]:
为了达到治疗的目标,通常需要联合使用多种药物。初始降压治疗应包括一种ACEI或ARB,单独或联合其他降压药,但不建议ACEI和ARB联合应用。
合并射血分数降低的HF(HFrEF):首选血管紧张素受体-脑啡肽酶抑制剂(ARNI)、ACEI/ARB、β受体阻滞剂和醛固酮受体拮抗剂。如仍未能控制高血压,推荐钙离子通道阻滞剂。
合并射血分数保留的HF(HFpEF):虽然暂无证据表明ACEI/ARB、β受体阻滞剂和醛固酮受体拮抗剂可降低此类患者的死亡率和改善预后,但用于降压治疗仍值得推荐,如仍未能控制高血压,推荐应用钙离子通道阻滞剂。
在CKD G3及以上的患者使用ACEI或ARB时,初始剂量可减半,严密监测血钾和血肌酐水平以及eGFR,并及时调整药物剂量和剂型。
对于非透析依赖CKD和尚有残余肾功能的CKD G5D患者,推荐在容量负荷过重的CKD相关心肌病患者应用利尿剂(噻嗪类、袢利尿剂和保钾利尿剂),同时应该监测容量状况和电解质。
推荐CKD相关心肌病患者应该早期使用改善心肌重构、抑制心肌纤维化、炎症和氧化应激,控制HF症状、改善心血管结局的药物。

图2. 比较常规降压治疗对心脏的影响
04新型药物在CKD相关心肌病中的应用
ARNI
ARNI是由脑啡肽酶抑制剂和血管紧张素受体阻滞剂组成的共晶复合物(如沙库巴曲缬沙坦)。它可以有效抑制脑啡肽酶,增强利钠肽系统的有益作用,并阻断血管紧张素Ⅱ-1受体,从而协同发挥舒张血管、预防和逆转心血管重构和促尿钠排泄等作用。多项随机对照研究证实了ARNI的降压疗效,且相较于依那普利,ARNI可快速逆转心脏重构。沙库巴曲缬沙坦在透析人群中可改善心脏结构及功能[9,10]。美国心脏病学会(ACC)/美国心脏协会(AHA)和美国心力衰竭学会(HFSA)建议在慢性症状性HFrEF患者中使用ACEI、ARB或ARNI,以降低发病率和死亡率。2022年AHA/ACC/HFSA心力衰竭管理指南及中国心力衰竭诊断和治疗指南(2024)均建议使用ARNI来治疗HFpEF的HF患者。
MRA
盐皮质激素受体拮抗剂(MRA)可以减轻左心室肥厚、改善慢性HF、抑制血管纤维化和硬化,以及减少炎症。在CKD患者中,螺内酯可以降低CKD患者LVM,改善动脉硬化,并且这种效果可能独立于血压控制。尽管如此,对于接受透析的患者,MRA的益处与风险仍存在不确定性。一项Cochrane荟萃分析发现,使用MRA可能与降低全因和心血管死亡风险相关[11]。
SGLT2i
钠-葡萄糖协同转运体(SGLT2i)抑制剂对糖尿病患者和非糖尿病患者都有益,可降低心脏负荷,改善内皮功能和血管张力,增强心肌收缩力,并可能保护心脏。研究指出,这些药物能改善心肌功能,促进自噬,减少炎症和氧化应激,阻止心肌纤维化,并有助于逆转心室重构。例如,恩格列净和达格列净可以减少左室质量,并带来其他心脏益处[2]。
05其他综合管理措施
(1)贫血的管理
共识[1]指出:
对于CKD相关心肌病患者,推荐血红蛋白(Hb)的目标值维持在110~120 g/L。
对于CKD相关心肌病患者,建议在Hb<100 g/L时开始使用红细胞生成刺激剂(ESAs),前提是转铁蛋白饱和度(TSAT)>20%且铁蛋白>200 ng/ml;如合并难以控制的高血压和/或Hb≥90 g/L且合并HF则不推荐ESAs。
对于CKD相关心肌病患者,建议在Hb<100 g/L时可以应用低氧诱导因子脯氨酰羟化酶抑制剂( HIF-PHI)纠正贫血。
对于CKD相关心肌病合并贫血的患者,如TSAT≤20%且铁蛋白≤200 ng/ml,推荐补充铁剂。特别是合并有症状的慢性HF患者,应该每年通过测量血清铁蛋白和TSAT评估是否存在铁缺乏。补铁3个月后,应重新评估铁状态,并根据需要提供进一步补充。
推荐CKD相关心肌病合并慢性HF患者,补充铁剂治疗时,以静脉补铁为佳,如羧基麦芽糖铁或异麦芽糖酐铁,以改善HF症状、改善运动耐量及生活质量,并减少再住院。
(2)CKD-MBD的管理
CKD-MBD与多种因素相关,包括FGF-23升高、Klotho减少、PTH和维生素D紊乱,导致钙、磷代谢紊乱,增加心血管疾病和死亡风险。FGF-23水平升高是CKD相关心肌病的主要原因,能直接导致心脏肥大。拟钙剂能减少FGF-23水平,降低PTH水平,改善心脏功能。维生素D是CKD-MBD的重要因素,与矿物质代谢控制和心血管健康相关。减少磷摄入、补充钙和维生素D可降低血磷,升高血钙,改善PTH分泌,防治心血管钙化和心肌纤维化。对于严重甲状旁腺功能亢进和药物治疗无效的患者,建议甲状旁腺切除术[2]。
共识[1]推荐:
对于CKD相关心肌病患者,推荐早期纠正钙磷代谢紊乱,积极治疗继发性甲状旁腺功能亢进症。
推荐对eGFR<60 ml/(min·1.73m2)的CKD患者监测CKD-MBD指标,定期监测血清钙、磷、甲状旁腺激素(PTH)以及维生素D水平,并定期评估心血管钙化。
推荐对于持续性高PTH或PTH进行性升高的患者,应评估是否存在可改善的因素,如高磷血症、高磷摄入、低钙血症及维生素D缺乏,并及时纠正。
(3)体重的管理[1]
共识[1]指出:
推荐对于超重的CKD患者应当均衡饮食,将体质量指数(BMI)保持在合适范围(<2 5 kg/m2)。
建议CKD相关心肌病患者限制饮食中钠的摄入<3 g/d(食盐摄入量<6 g/d),其中维持性血液透析患者建议限制饮食中钠的摄入<2 g/d。
建议所有CKD患者(包括透析患者)保持积极的生活方式,在专业指导下运动康复。
总结
CKD相关心肌病的病理生理机制复杂,多种CKD并发症如容量负荷过高、高血压、贫血、CKD-MBD等互相作用,这给患者的诊断和管理带来了极大的挑战。目前,通过有效的血压控制来逆转LVH是可行的,但其效果是否独立于血压控制还需要进一步的验证,需要进一步的研究来确定CKD患者中LVH的逆转与预后改善之间的关系。对于不同的高血压目标人群,包括非肾病、肾病非透析和透析依赖患者,需要寻找更适合他们的血压目标值和药物。
参考文献
[1] 中国血液净化. 2024年8月, 第23卷, 第8期: 561-580.
[2] Journal of Human Hypertension (2023) 37:1–19.
[3] Canadian Journal of Kidney Health 2018; 5: 1-18
[4] N Engl J Med 2023;389:700-9.
[5] ESC Heart Failure2021;8: 2045–2057
[6] Journal of Cardiovascular Magnetic Resonance (2019) 21:21
[7] Am J Med. 2003;115:41–46.
[8] Hypertension. 2009;54:1084-1091.
[9] N Engl J Med 2014;371:993-1004.
[10] J Cardiol . 2019 Oct;74(4):372-380
[11] N Engl J Med 2021;385:2252-63.
[12] Am J Hypertens. 2014 Feb;27(2):146-56
[13] Am J Kidney Dis. 2016;68(4):554-563
- 推荐文章
IgA肾病当前的诊断困境及生物标志物的研究进展
传统 vs. 新型盐皮质激素拮抗剂:谁在护心伤肾?——基于近3万例患者的肾脏安全性大揭秘
患者小课堂|你、我、他,谁更容易患肾脏病?一文速览
病例分享 | 20多岁冶金厂年轻小伙子咳嗽咯血,居然是这种罕见且凶险的肾病在捣乱!
氟氢可的松治疗成功纠正他克莫司诱导的低钠血症病例
世界睡眠日特别提醒!如何应对CKD患者的睡眠障碍
跟随国际IgA肾病联盟主席Jonathan Barratt教授,了解IgA肾病治疗最新进展——WCN 2025回顾
急性肾盂肾炎前瞻观察:哪些因素左右患者出院后的肾脏结局?
紧跟指南,护肾趁早!T2DM相关CKD治疗须与时俱进
肾域华章丨中大一院肾内科研究揭示IgA肾病伴肾病综合征患者的临床病理特征及与预后的关系
容易纠缠不清的病魔!泌尿系感染之肾盂肾炎,不容小觑
APRIL在IgA肾病治疗中的潜力
中国国医节 | 传承与创新:中西合璧挑战狼疮肾炎——黄芪的作用
蛋白尿与年轻人心搏骤停相关——CKD较严重者,风险更高
JASN|补体抑制剂治疗IgA肾病有望实现两个月给药一次?国际IgA肾病领军者Barratt教授最新研究揭晓
病例分享|不期而遇的困扰!丙肝患者短期内出现尿量减少,肌酐升高,警惕罕见的冷球蛋白血症肾病
2025年世界肾脏日:您的肾脏还好吗?早检查=保健康
ADPKD患者肾功能越差,疼痛频率越高,对睡眠的影响越显著
前沿进展|ORIGIN 2期研究结果重磅揭晓:阿塞西普长期治疗IgA肾病有效且安全
患者小课题|别让糖尿病伤了肾——如何早期发现糖尿病肾病
世界肾脏日丨早检查,保健康,拉紧心肾损伤警报线,优化T2DM相关CKD管理策略
Nature子刊|一文全解狼疮性肾炎相关CKD的管理理念与未来研究方向
狼疮性肾炎:突破传统,探索治疗新前沿
IgA肾病:IgA1免疫复合物的面面观
两款药物即将上市!FDA批准呋塞米注射液用于治疗CKD水肿;接受Obinutuzumab治疗狼疮肾炎的补充许可申请
慢性肾脏病患者的“症状关卡”,如何巧妙通关?
“心”感染,“肾”也跟着坏掉?感染性心内膜炎相关性肾炎,究竟是怎么一回事儿?
CKD相关心肌病的早期诊断与规范治疗
睡眠质量差,血液透析患者的“隐形杀手”!
WCN中国之声 | 郝传明教授:低氧诱导因子脯氨酰羟化酶抑制剂在慢性肾脏病贫血治疗中的两面性
探索替尔泊肽在肾脏疾病中的双重激动作用:GLP-1激动剂与潜在GIP介导的获益
什么是CKD相关心肌病?
IgA肾病的新兴疗法与当前争议
警惕!应用噻嗪类利尿剂后出现早期低钠血症,死亡风险或将大幅攀升!
高强度间歇训练显著降低老年人肾功能快速下降风险
指南共识 | 2024 ACR狼疮肾炎诊疗指南更新解读:从序贯治疗到联合免疫靶向的范式转变
病例分享丨中年男子3个月内肾功能快速恶化,原因究竟为何般?这种临床危重症,值得警惕
前沿进展丨常染色体显性多囊肾病患者的肾脏非线性生长模式与不良预后密切相关
糖衣炮弹下的肾脏危机!糖尿病最常见、最严重的并发症之一——糖尿病肾脏疾病
患者小课堂| IgA 肾病:症状背后的真相与应对策略
NEJM丨伊普可泮治疗IgA肾病Ⅲ期临床研究APPLAUSE-IgAN结果揭晓
狼疮性肾炎:流行病学特征与发病机制的最新研究进展
Kidney360|从成像模式看中国ADPKD患者临床特征及肾脏结局走向
NDT丨蛋白尿还是白蛋白尿?IgA肾病风险预测的关键指标再评估
WCN 2025|非奈利酮早期起始,持续治疗对于最大化患者临床效益至关重要
对激素(全身或肠道释放型布地奈德)耐药的肾病综合征范围蛋白尿的IgA肾病:他克莫司能否作为替代药物?
WCN 2025|非奈利酮显著降低蛋白尿,且疗效与安全性不受肾切除术史影响
病例分享 | 血透老人多病共存,内环境如同“纸糊“!棘手局面,肾病科医师如何破局?
WCN 2025|非奈利酮在肾移植后患者中安全有效,值得进一步探索
患者小课堂丨肾虚、肾亏是慢性肾炎吗?
NEJM前沿速递|阿曲生坦治疗IgA肾病Ⅲ期ALIGN试验的中期分析结果正式见刊
微小病变肾病,肾病综合征的第三大原因!“微小”病变也不容忽视,及时准确诊疗很关键
奥妥珠单抗有效保护LN患者的肾功能,显著减少LN发作,还具有减少糖皮质激素使用的潜力:NOBILITY试验事后分析
CKJ|浆细胞与补体或许是MN的潜在治疗靶点
揭秘BAFF、APRIL在IgA肾病中的作用以及治疗研究进展
