- 首页 > 正文
臧秀娟教授:慢性肾脏病合并骨质疏松症发病机制和诊治进展
发表时间:2024-12-24 16:48:37
骨质疏松症是慢性肾脏病(CKD)相关性矿物质及骨代谢紊乱(CKD-MBD)的重要表现之一。由于复杂的代谢及药物治疗环境,CKD患者具有更高的骨质疏松和骨折风险,尤其是中、重度患者。骨质疏松还增加CKD患者的心血管疾病风险。深入了解CKD合并骨质疏松症对于改善CKD患者的生活质量和长期预后具有重要意义。本文中,上海交通大学医学院附属松江医院的臧秀娟教授对CKD合并骨质疏松症的发病机制、危险因素及风险评估、药物选择与管理进行了全面梳理。
一、CKD合并骨质疏松症发病机制
骨质疏松是遗传因素和环境因素交互作用的结果。伴有肾小球滤过率降低的CKD,无论病因如何,都会导致1-α羟基化维生素D水平降低、继发性甲状旁腺功能亢进和骨吸收增加[1]。CKD影响骨质疏松症和骨强度下降的潜在机制见图1[2]。
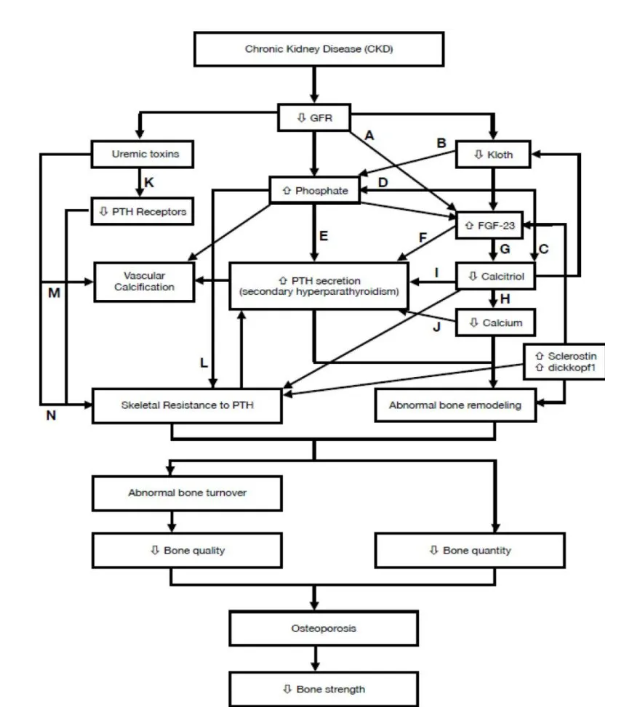
图1. CKD患者骨质疏松的潜在机制[2]
(A)FGF-23清除率降低;(B)降低FGF-23的磷酸化作用;(C)抑制肾近端小管1α-羟化酶;(D)增加肾小管对磷酸盐的吸收;(E)诱导低钙血症,降低骨化三醇,增加PTH基因表达和PTH分泌;(F)由于FGFR1和kloth蛋白的减少而降低其抑制作用;(G)抑制1α-羟化酶;(H)减少钙在肠道中的吸收,减少钙从骨骼中的释放;(I)降低甲状旁腺细胞中VDRs的数量,并降低其对甲状旁腺的抑制作用;(J)增加甲状旁腺PTH mRNA浓度,降低甲状旁腺钙敏感受体(CaSR)的表达;(K)硫酸吲哚酚降低PTH1受体的表达;(L)无机磷酸盐和钙的物理化学沉淀可间接引起骨骼对甲状旁腺激素的抗性;(M)硫酸吲哚酚增加Kloth基因的CpG超甲基化;(N)对甲酚硫酸盐诱导成骨细胞功能障碍。
钙磷代谢紊乱
CKD患者肾功能受损,磷酸盐排泄受阻及肾小管对钙的重吸收减少,当GFR<20 ml/(min·1.73 m2)时,血磷水平升高、血清钙降低,出现钙磷代谢紊乱,可表现为高磷血症、低钙血症或高钙血症,这些异常均可促进骨质疏松的发生和发展。
高血清磷酸盐被认为是CKD患者代谢紊乱的始动因素,其使炎症因子过度释放,导致CKD患者骨密度降低的同时导致FGF-23和PTH升高及Klotho低表达,与CKD合并骨质疏松症的发生发展密切相关。
低钙血症在CKD患者中很常见,甲状旁腺中某些膜结合的钙敏感受体(CaSR)感知到血清钙下降,释放PTH,使血清钙升高。此外,甲状旁腺组织的增生会减少增大的甲状旁腺中CaSR的数量和表达,导致钙对PTH抑制不足,PTH持续升高会刺激破骨细胞活性,增加骨吸收和钙释放,导致骨密度降低,以及异位软组织和血管钙化的发生。
维生素D缺乏与不足
CKD患者由于肾脏功能下降,1α-羟化酶活性降低,可能导致维生素D的活化形式产生不足,进而引发维生素D缺乏。维生素D缺乏时(<15 nmol/L),随着钙水平降低,骨形成和骨小梁矿化也减少。其缺乏可导致骨质疏松和骨折风险增加。维生素D缺乏还可影响肠道对钙的吸收和骨骼对钙的利用,进一步加剧骨质疏松的病情[3]。
FGF-23和Klotho
FGF-23是一种骨细胞分泌的磷酸化激素,在CKD早期时升高,FGF-23升高降低了肾脏磷酸盐的重吸收,导致尿磷排泄增加,并抑制骨化三醇合成。随着CKD的进展,FGF-23抑制了维生素D的活性并增加其分解代谢,维生素D缺乏或不足,以及高磷血症导致CKD患者发生继发性甲状旁腺功能亢进[4]。
辅助受体Klotho增加了FGF-23对其受体的亲和力,慢性肾功能不全早期,Klotho降低可能会减弱FGF-23对磷酸盐排泄的作用。
继发性甲状旁腺功能亢进
CKD患者常伴随继发性甲状旁腺功能亢进,磷酸盐滞留、游离钙水平下降、活性维生素D水平下降、FGF-23水平升高,CaSR、FGF-23受体和Klotho在甲状旁腺表达减少均会导致PTH升高。PTH过度分泌可加速骨转换,导致骨量减少和骨质疏松。SHPT还可引起软组织钙化等严重并发症,进一步影响患者的生活质量和预后[3]。
慢性炎症及代谢性酸中毒
CKD患者体内常存在慢性炎症状态,大量炎症因子的激活如核因子κB可刺激破骨细胞活性,促进骨吸收和骨质疏松的发生,是骨平衡的重要调节因素。同时,CKD患者常伴有代谢性酸中毒,酸性环境可影响骨骼的矿化过程,导致骨质流失和骨质疏松。慢性炎症和代谢性酸中毒还可相互影响,共同加剧骨质疏松的进展。
骨脂肪细胞
研究发现CKD患者骨组织活检发现脂滴增多、破骨细胞增多以及成骨细胞减少,这提示骨脂肪细胞可能参与骨质疏松的发展。CKD骨脂肪细胞通过分泌细胞因子、表达游离脂肪酸来促进骨质疏松[5]。
二、CKD合并骨质疏松症的危险因素和风险评估
1. 危险因素
骨质疏松症可控的危险因素包括不健康生活方式、患有骨代谢的疾病、使用影响骨代谢的药物;不可控因素包括种族、增龄、女性绝经、脆性骨折家族史等[6]。CKD患者骨质疏松症的危险因素见图2。
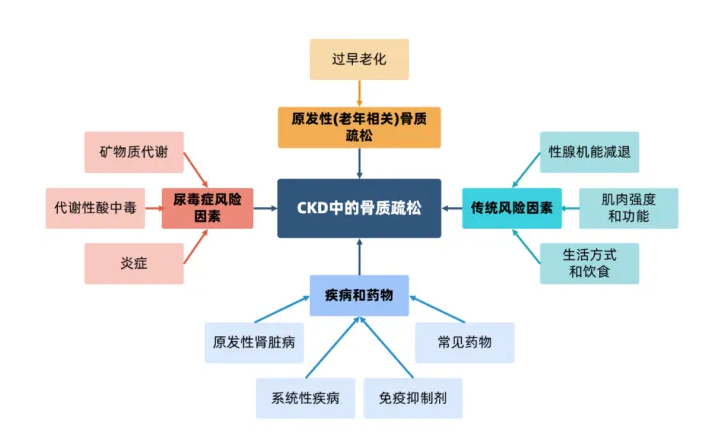
图2. CKD患者骨质疏松症的危险因素[7]
2. 骨质疏松风险评估
骨量和骨质量能够预测CKD的骨折风险。骨密度是反映骨质量的一个重要指标。骨密度及骨测量常用的方法包括:双能X线吸收法(DXA)、定量CT(QCT)、外周骨密度测量、超声波骨密度测量法(QUS)、骨小梁分数。
骨组织形态测量学研究仍然是肾性骨病(ROD)诊断和分类的“金标准”。通过骨活检,可以了解是否存在骨质疏松及骨质疏松症的程度。
骨质疏松症风险的评估工具包括IOF一分钟测试题、OSTA[6]。前者仅能用于初步筛查疾病风险;后者的特异性不高,且仅适用于绝经后妇女。
FRAX是世界卫生组织(WHO)推荐的评估患者未来10年髋部及主要骨质疏松性骨折(椎体、前臂、髋部或肱骨近端骨折)发生率的骨折风险预测工具。我国指南[6]建议采用国际通用的阈值,即FRAX预测的髋部骨折发生率≥3%或任何主要骨质疏松性骨折发生率≥20%,为骨质疏松性骨折高危患者,建议给予药物治疗。研究提示目前FRAX预测结果可能低估了国人的骨折风险。适合中国人群的骨折预测工具有待建立。
因此,CKD患者骨质疏松症的诊断与风险分层工具[8]包括:①骨密度检测(DXA):在所有CKD阶段中,低T值与骨折风险增加相关。T值每降低1个单位,骨折风险大约翻倍;②FRAX工具:RAX工具可以用于所有CKD阶段的骨折风险评估;③骨转换标志物:可以在个别情况下测量骨转换标志物,以监测治疗效果;④骨活检:尤其在CKD G5期[eGFR<15 ml/(min·1.73m2)]或接受透析的患者中,可以考虑进行骨活检。
三、CKD合并骨质疏松症药物选择与管理
1. CKD患者骨质疏松症的具体治疗建议
CKD患者骨质疏松的管理应以全面管理CKD-MBD风险因素为基础,控制血磷是关键[9]。纠正CKD-MBD生化异常,如维生素D缺乏、高磷血症和甲状旁腺功能亢进,是对CKD相关骨质疏松症进行任何特定治疗之前的第一步。
使用骨健康基本补充剂是骨质疏松症防治的基础措施之一。在骨质疏松症防治中,钙剂应与其他药物联合使用。对于CKD患者,首先建议接受充足的阳光照射。对于维生素D缺乏或不足者,应给予维生素D补充剂[6]。CKD骨质疏松症患者进行CKD-MBD治疗时需注意血管钙化及心脏瓣膜钙化情况,避免钙剂的补充导致高钙血症进而增加患者死亡风险。不规范使用活性维生素D及其类似物可过度抑制PTH导致低转化骨病的发生。在其使用过程中需严密监测血钙、磷、PTH,若发生高磷血症,应首当积极降磷,建议减少或停用活性维生素D及其类似物。
CKD患者骨质疏松症的具体治疗建议[8]:
CKD G1-G2期:应按照普通人群的建议治疗骨质疏松症。
CKD G3-G5D期:在开始骨质疏松治疗之前,应优先处理CKD-MBD的实验室异常。
CKD G3期且PTH在正常范围内,伴有骨质疏松性骨折或根据FRAX工具评估的高骨折风险:按照普通人群的建议治疗骨质疏松症。
CKD G4-G5期且伴有骨质疏松性骨折(继发性预防):建议个性化治疗骨质疏松症。
CKD G4-G5期且伴有高骨折风险(例如FRAX工具评估的主要骨质疏松性骨折风险>20%或髋部骨折风险>5%),但未发生骨质疏松性骨折(一级预防):可以考虑并在个别情况下开始治疗骨质疏松症。
CKD G4-G5D期:在开始抗吸收治疗后的1至2周内应监测血钙水平。
2. CKD合并骨质疏松症的药物选择
抗骨质疏松症药物按作用机制分为骨吸收抑制剂(双膦酸盐、RANKL单克隆抗体、雌激素或SERMs、降钙素)、骨形成促进剂(甲状旁腺激素类似物)、双重作用药物、其他机制类药物及中成药。骨质疏松症治疗药物的选择已逐步转为依据骨折风险分层的治疗策略。符合骨质疏松症诊断的患者均属于骨折高风险者。骨质疏松症患者合并以下任意一条危险因素,均属于极高骨折风险者:①近期发生脆性骨折(特别是24个月内发生的脆性骨折);②接受抗骨质疏松症药物治疗期间仍发生骨折;③多发性脆性骨折(包括椎体、髋部、肱骨近端或桡骨远端等);④正在使用可导致骨骼损害的药物如高剂量糖皮质激素(≥7.5 mg/d泼尼松龙超过3个月)等;⑤DXA测量骨密度T-值<-3.0;⑥高跌倒风险或伴有慢性疾病导致跌倒史。⑦FRAX计算未来10年主要骨质疏松骨折风险>30%或髋部骨折风险>4.5%[6]。
对于骨折高风险者,首选阿仑膦酸钠、利塞膦酸钠等;若口服药物不耐受,可选择唑来膦酸或地舒单抗等。骨折极高风险者,初始药物可选择特立帕肽、唑来膦酸、地舒单抗、罗莫佐单抗。髋部骨折极高风险的患者,优先选择唑来膦酸或地舒单抗[10, 11]。
双膦酸盐是目前临床上应用最为广泛的抗骨质疏松症药物。需注意:①RANKL单克隆抗体地舒单抗短效作用药物,不存在药物假期,一旦停用,需要序贯双膦酸盐类或其他药物,以防止骨密度下降或骨折风险增加;②对于选择性雌激素受体调节剂(SERMs)雷洛昔芬,有静脉栓塞病史及有血栓倾向者,如长期卧床和久坐者禁用;③对于甲状旁腺激素类似物(PTHa)特立帕肽,在我国目前其疗程仍限制在24个月,停药后建议序贯骨吸收抑制剂治疗以维持或增加骨密度;④硬骨抑素单克隆抗体罗菲佐单抗尚未在中国上市。
3. 使用抗骨质疏松症药物疗程
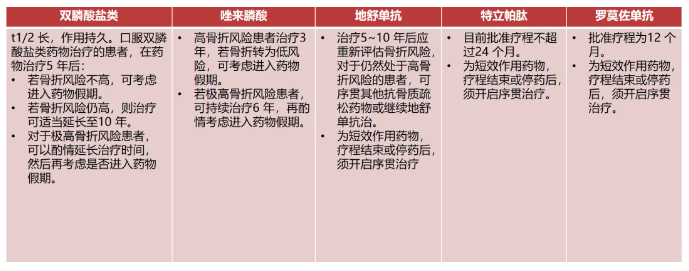
抗骨质疏松症药物疗程应个体化、长期化,所有治疗至少应坚持1年,在治疗前和停药前均须全面评估骨质疏松性骨折的发生风险,并对患者进行骨折风险分层管理(表1)。
表1. 使用抗骨质疏松症药物疗程
4.序贯治疗的方案推荐
骨质疏松症的长期药物序贯治疗不仅有助于有效增加骨密度,持续降低骨折风险,而且有显著的药物经济学价值。不同作用机制药物、相同作用机制药物的常见序贯治疗方案见图3。

图3. 常见抗骨质疏松药物序贯治疗方案
5. 康复治疗
针对骨质疏松症的康复治疗主要包括运动疗法、物理因子治疗、作业疗法及康复工程等(图4)[6]。建议每周进行三次主要肌肉群的力量训练,包括每周进行四次、每次40分钟的有氧训练;每周进行三次协调和平衡训练;每周进行3至7次的柔韧性训练[8]。

总结
骨质疏松是CKD人群中常见且容易被忽视的一种并发症,可导致骨折和心血管事件风险增加,影响患者生存质量和远期预后,应对CKD人群加强关注。由于CKD患者的具体病情和身体状况各异,应尽早监测CKD患者中骨质疏松性的骨折风险,适时进行危险分层,给予个体化的治疗方案。此外,目前的治疗方案可能无法满足所有患者的需求;当前的治疗方法主要集中在短期内改善骨密度和降低骨折风险,缺乏长期疗效的评估和研究,这些可能是未来研究的方向。
专家简介

臧秀娟 教授
医学博士,主任医师
硕士研究生导师
上海交通大学医学院附属松江医院肾内科主任,上海市人大代表
学术任职
中国药理学会肾脏病药理专业委员
中国康复医学会肾脏病康复专业委员
中国民族卫生协会卫生健康技术推广专家委员会副主任委员
上海市医学会肾脏病学会委员、区县学组副组长
上海市医师学会肾脏病学会专业委员
上海市康复医学会肾脏病康复专业常委
上海市松江区医学会肾脏病质控组组长
研究领域
肾小球疾病、慢性肾脏病管理、腹膜透析临床和基础研究
主持参与国家级、上海市科委等省部级课题10余项,国内外发表文章50余篇(包括JASN)主编著作2部,参编著作5部,国家级实用型专利二项,获上海市医学科技成果三等奖、上海市康复医学三等奖、中国医院管理学会医院管理创新奖
参考文献
1. Environ Sci Pollut Res Int. 2022 May;29(21):31042-31058
2. Int J Mol Sci. 2020 Sep; 21(18): 6846.
3. Zhonghua Nei Ke Za Zhi. 2020 Feb 1;59(2):104-116.
4. Life (Basel). 2024 Mar 21;14(3):418.
5. Chinese Journal of Nephrology, 2019, 35(6): 476-480.
6. 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊疗指南(2022)[J].中国全科医学,2023,26(14):1671-1691.
7. J?rgensen HS, et al. Calcif Tissue Int. 2021 Apr;108(4):496-511.
8. Wien Med Wochenschr. 2023 Oct;173(13-14):299-318.
9. Khairallah P, et al. Clin J Am Soc Nephrol. 2018 Jun 7;13(6):962-969.
10. Arch Osteoporos. 2022 Apr 5;17(1):58.
11. Endocr Pract. 2020 May;26(Suppl 1):1-46.
一、CKD合并骨质疏松症发病机制
骨质疏松是遗传因素和环境因素交互作用的结果。伴有肾小球滤过率降低的CKD,无论病因如何,都会导致1-α羟基化维生素D水平降低、继发性甲状旁腺功能亢进和骨吸收增加[1]。CKD影响骨质疏松症和骨强度下降的潜在机制见图1[2]。

图1. CKD患者骨质疏松的潜在机制[2]
(A)FGF-23清除率降低;(B)降低FGF-23的磷酸化作用;(C)抑制肾近端小管1α-羟化酶;(D)增加肾小管对磷酸盐的吸收;(E)诱导低钙血症,降低骨化三醇,增加PTH基因表达和PTH分泌;(F)由于FGFR1和kloth蛋白的减少而降低其抑制作用;(G)抑制1α-羟化酶;(H)减少钙在肠道中的吸收,减少钙从骨骼中的释放;(I)降低甲状旁腺细胞中VDRs的数量,并降低其对甲状旁腺的抑制作用;(J)增加甲状旁腺PTH mRNA浓度,降低甲状旁腺钙敏感受体(CaSR)的表达;(K)硫酸吲哚酚降低PTH1受体的表达;(L)无机磷酸盐和钙的物理化学沉淀可间接引起骨骼对甲状旁腺激素的抗性;(M)硫酸吲哚酚增加Kloth基因的CpG超甲基化;(N)对甲酚硫酸盐诱导成骨细胞功能障碍。
钙磷代谢紊乱
CKD患者肾功能受损,磷酸盐排泄受阻及肾小管对钙的重吸收减少,当GFR<20 ml/(min·1.73 m2)时,血磷水平升高、血清钙降低,出现钙磷代谢紊乱,可表现为高磷血症、低钙血症或高钙血症,这些异常均可促进骨质疏松的发生和发展。
高血清磷酸盐被认为是CKD患者代谢紊乱的始动因素,其使炎症因子过度释放,导致CKD患者骨密度降低的同时导致FGF-23和PTH升高及Klotho低表达,与CKD合并骨质疏松症的发生发展密切相关。
低钙血症在CKD患者中很常见,甲状旁腺中某些膜结合的钙敏感受体(CaSR)感知到血清钙下降,释放PTH,使血清钙升高。此外,甲状旁腺组织的增生会减少增大的甲状旁腺中CaSR的数量和表达,导致钙对PTH抑制不足,PTH持续升高会刺激破骨细胞活性,增加骨吸收和钙释放,导致骨密度降低,以及异位软组织和血管钙化的发生。
维生素D缺乏与不足
CKD患者由于肾脏功能下降,1α-羟化酶活性降低,可能导致维生素D的活化形式产生不足,进而引发维生素D缺乏。维生素D缺乏时(<15 nmol/L),随着钙水平降低,骨形成和骨小梁矿化也减少。其缺乏可导致骨质疏松和骨折风险增加。维生素D缺乏还可影响肠道对钙的吸收和骨骼对钙的利用,进一步加剧骨质疏松的病情[3]。
FGF-23和Klotho
FGF-23是一种骨细胞分泌的磷酸化激素,在CKD早期时升高,FGF-23升高降低了肾脏磷酸盐的重吸收,导致尿磷排泄增加,并抑制骨化三醇合成。随着CKD的进展,FGF-23抑制了维生素D的活性并增加其分解代谢,维生素D缺乏或不足,以及高磷血症导致CKD患者发生继发性甲状旁腺功能亢进[4]。
辅助受体Klotho增加了FGF-23对其受体的亲和力,慢性肾功能不全早期,Klotho降低可能会减弱FGF-23对磷酸盐排泄的作用。
继发性甲状旁腺功能亢进
CKD患者常伴随继发性甲状旁腺功能亢进,磷酸盐滞留、游离钙水平下降、活性维生素D水平下降、FGF-23水平升高,CaSR、FGF-23受体和Klotho在甲状旁腺表达减少均会导致PTH升高。PTH过度分泌可加速骨转换,导致骨量减少和骨质疏松。SHPT还可引起软组织钙化等严重并发症,进一步影响患者的生活质量和预后[3]。
慢性炎症及代谢性酸中毒
CKD患者体内常存在慢性炎症状态,大量炎症因子的激活如核因子κB可刺激破骨细胞活性,促进骨吸收和骨质疏松的发生,是骨平衡的重要调节因素。同时,CKD患者常伴有代谢性酸中毒,酸性环境可影响骨骼的矿化过程,导致骨质流失和骨质疏松。慢性炎症和代谢性酸中毒还可相互影响,共同加剧骨质疏松的进展。
骨脂肪细胞
研究发现CKD患者骨组织活检发现脂滴增多、破骨细胞增多以及成骨细胞减少,这提示骨脂肪细胞可能参与骨质疏松的发展。CKD骨脂肪细胞通过分泌细胞因子、表达游离脂肪酸来促进骨质疏松[5]。
二、CKD合并骨质疏松症的危险因素和风险评估
1. 危险因素
骨质疏松症可控的危险因素包括不健康生活方式、患有骨代谢的疾病、使用影响骨代谢的药物;不可控因素包括种族、增龄、女性绝经、脆性骨折家族史等[6]。CKD患者骨质疏松症的危险因素见图2。

图2. CKD患者骨质疏松症的危险因素[7]
2. 骨质疏松风险评估
骨量和骨质量能够预测CKD的骨折风险。骨密度是反映骨质量的一个重要指标。骨密度及骨测量常用的方法包括:双能X线吸收法(DXA)、定量CT(QCT)、外周骨密度测量、超声波骨密度测量法(QUS)、骨小梁分数。
骨组织形态测量学研究仍然是肾性骨病(ROD)诊断和分类的“金标准”。通过骨活检,可以了解是否存在骨质疏松及骨质疏松症的程度。
骨质疏松症风险的评估工具包括IOF一分钟测试题、OSTA[6]。前者仅能用于初步筛查疾病风险;后者的特异性不高,且仅适用于绝经后妇女。
FRAX是世界卫生组织(WHO)推荐的评估患者未来10年髋部及主要骨质疏松性骨折(椎体、前臂、髋部或肱骨近端骨折)发生率的骨折风险预测工具。我国指南[6]建议采用国际通用的阈值,即FRAX预测的髋部骨折发生率≥3%或任何主要骨质疏松性骨折发生率≥20%,为骨质疏松性骨折高危患者,建议给予药物治疗。研究提示目前FRAX预测结果可能低估了国人的骨折风险。适合中国人群的骨折预测工具有待建立。
因此,CKD患者骨质疏松症的诊断与风险分层工具[8]包括:①骨密度检测(DXA):在所有CKD阶段中,低T值与骨折风险增加相关。T值每降低1个单位,骨折风险大约翻倍;②FRAX工具:RAX工具可以用于所有CKD阶段的骨折风险评估;③骨转换标志物:可以在个别情况下测量骨转换标志物,以监测治疗效果;④骨活检:尤其在CKD G5期[eGFR<15 ml/(min·1.73m2)]或接受透析的患者中,可以考虑进行骨活检。
三、CKD合并骨质疏松症药物选择与管理
1. CKD患者骨质疏松症的具体治疗建议
CKD患者骨质疏松的管理应以全面管理CKD-MBD风险因素为基础,控制血磷是关键[9]。纠正CKD-MBD生化异常,如维生素D缺乏、高磷血症和甲状旁腺功能亢进,是对CKD相关骨质疏松症进行任何特定治疗之前的第一步。
使用骨健康基本补充剂是骨质疏松症防治的基础措施之一。在骨质疏松症防治中,钙剂应与其他药物联合使用。对于CKD患者,首先建议接受充足的阳光照射。对于维生素D缺乏或不足者,应给予维生素D补充剂[6]。CKD骨质疏松症患者进行CKD-MBD治疗时需注意血管钙化及心脏瓣膜钙化情况,避免钙剂的补充导致高钙血症进而增加患者死亡风险。不规范使用活性维生素D及其类似物可过度抑制PTH导致低转化骨病的发生。在其使用过程中需严密监测血钙、磷、PTH,若发生高磷血症,应首当积极降磷,建议减少或停用活性维生素D及其类似物。
CKD患者骨质疏松症的具体治疗建议[8]:
CKD G1-G2期:应按照普通人群的建议治疗骨质疏松症。
CKD G3-G5D期:在开始骨质疏松治疗之前,应优先处理CKD-MBD的实验室异常。
CKD G3期且PTH在正常范围内,伴有骨质疏松性骨折或根据FRAX工具评估的高骨折风险:按照普通人群的建议治疗骨质疏松症。
CKD G4-G5期且伴有骨质疏松性骨折(继发性预防):建议个性化治疗骨质疏松症。
CKD G4-G5期且伴有高骨折风险(例如FRAX工具评估的主要骨质疏松性骨折风险>20%或髋部骨折风险>5%),但未发生骨质疏松性骨折(一级预防):可以考虑并在个别情况下开始治疗骨质疏松症。
CKD G4-G5D期:在开始抗吸收治疗后的1至2周内应监测血钙水平。
2. CKD合并骨质疏松症的药物选择
抗骨质疏松症药物按作用机制分为骨吸收抑制剂(双膦酸盐、RANKL单克隆抗体、雌激素或SERMs、降钙素)、骨形成促进剂(甲状旁腺激素类似物)、双重作用药物、其他机制类药物及中成药。骨质疏松症治疗药物的选择已逐步转为依据骨折风险分层的治疗策略。符合骨质疏松症诊断的患者均属于骨折高风险者。骨质疏松症患者合并以下任意一条危险因素,均属于极高骨折风险者:①近期发生脆性骨折(特别是24个月内发生的脆性骨折);②接受抗骨质疏松症药物治疗期间仍发生骨折;③多发性脆性骨折(包括椎体、髋部、肱骨近端或桡骨远端等);④正在使用可导致骨骼损害的药物如高剂量糖皮质激素(≥7.5 mg/d泼尼松龙超过3个月)等;⑤DXA测量骨密度T-值<-3.0;⑥高跌倒风险或伴有慢性疾病导致跌倒史。⑦FRAX计算未来10年主要骨质疏松骨折风险>30%或髋部骨折风险>4.5%[6]。
对于骨折高风险者,首选阿仑膦酸钠、利塞膦酸钠等;若口服药物不耐受,可选择唑来膦酸或地舒单抗等。骨折极高风险者,初始药物可选择特立帕肽、唑来膦酸、地舒单抗、罗莫佐单抗。髋部骨折极高风险的患者,优先选择唑来膦酸或地舒单抗[10, 11]。
双膦酸盐是目前临床上应用最为广泛的抗骨质疏松症药物。需注意:①RANKL单克隆抗体地舒单抗短效作用药物,不存在药物假期,一旦停用,需要序贯双膦酸盐类或其他药物,以防止骨密度下降或骨折风险增加;②对于选择性雌激素受体调节剂(SERMs)雷洛昔芬,有静脉栓塞病史及有血栓倾向者,如长期卧床和久坐者禁用;③对于甲状旁腺激素类似物(PTHa)特立帕肽,在我国目前其疗程仍限制在24个月,停药后建议序贯骨吸收抑制剂治疗以维持或增加骨密度;④硬骨抑素单克隆抗体罗菲佐单抗尚未在中国上市。
3. 使用抗骨质疏松症药物疗程
抗骨质疏松症药物疗程应个体化、长期化,所有治疗至少应坚持1年,在治疗前和停药前均须全面评估骨质疏松性骨折的发生风险,并对患者进行骨折风险分层管理(表1)。
表1. 使用抗骨质疏松症药物疗程

4.序贯治疗的方案推荐
骨质疏松症的长期药物序贯治疗不仅有助于有效增加骨密度,持续降低骨折风险,而且有显著的药物经济学价值。不同作用机制药物、相同作用机制药物的常见序贯治疗方案见图3。

图3. 常见抗骨质疏松药物序贯治疗方案
5. 康复治疗
针对骨质疏松症的康复治疗主要包括运动疗法、物理因子治疗、作业疗法及康复工程等(图4)[6]。建议每周进行三次主要肌肉群的力量训练,包括每周进行四次、每次40分钟的有氧训练;每周进行三次协调和平衡训练;每周进行3至7次的柔韧性训练[8]。

总结
骨质疏松是CKD人群中常见且容易被忽视的一种并发症,可导致骨折和心血管事件风险增加,影响患者生存质量和远期预后,应对CKD人群加强关注。由于CKD患者的具体病情和身体状况各异,应尽早监测CKD患者中骨质疏松性的骨折风险,适时进行危险分层,给予个体化的治疗方案。此外,目前的治疗方案可能无法满足所有患者的需求;当前的治疗方法主要集中在短期内改善骨密度和降低骨折风险,缺乏长期疗效的评估和研究,这些可能是未来研究的方向。
专家简介

臧秀娟 教授
医学博士,主任医师
硕士研究生导师
上海交通大学医学院附属松江医院肾内科主任,上海市人大代表
学术任职
中国药理学会肾脏病药理专业委员
中国康复医学会肾脏病康复专业委员
中国民族卫生协会卫生健康技术推广专家委员会副主任委员
上海市医学会肾脏病学会委员、区县学组副组长
上海市医师学会肾脏病学会专业委员
上海市康复医学会肾脏病康复专业常委
上海市松江区医学会肾脏病质控组组长
研究领域
肾小球疾病、慢性肾脏病管理、腹膜透析临床和基础研究
主持参与国家级、上海市科委等省部级课题10余项,国内外发表文章50余篇(包括JASN)主编著作2部,参编著作5部,国家级实用型专利二项,获上海市医学科技成果三等奖、上海市康复医学三等奖、中国医院管理学会医院管理创新奖
参考文献
1. Environ Sci Pollut Res Int. 2022 May;29(21):31042-31058
2. Int J Mol Sci. 2020 Sep; 21(18): 6846.
3. Zhonghua Nei Ke Za Zhi. 2020 Feb 1;59(2):104-116.
4. Life (Basel). 2024 Mar 21;14(3):418.
5. Chinese Journal of Nephrology, 2019, 35(6): 476-480.
6. 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊疗指南(2022)[J].中国全科医学,2023,26(14):1671-1691.
7. J?rgensen HS, et al. Calcif Tissue Int. 2021 Apr;108(4):496-511.
8. Wien Med Wochenschr. 2023 Oct;173(13-14):299-318.
9. Khairallah P, et al. Clin J Am Soc Nephrol. 2018 Jun 7;13(6):962-969.
10. Arch Osteoporos. 2022 Apr 5;17(1):58.
11. Endocr Pract. 2020 May;26(Suppl 1):1-46.
- 推荐文章
IgA肾病当前的诊断困境及生物标志物的研究进展
传统 vs. 新型盐皮质激素拮抗剂:谁在护心伤肾?——基于近3万例患者的肾脏安全性大揭秘
患者小课堂|你、我、他,谁更容易患肾脏病?一文速览
病例分享 | 20多岁冶金厂年轻小伙子咳嗽咯血,居然是这种罕见且凶险的肾病在捣乱!
氟氢可的松治疗成功纠正他克莫司诱导的低钠血症病例
世界睡眠日特别提醒!如何应对CKD患者的睡眠障碍
跟随国际IgA肾病联盟主席Jonathan Barratt教授,了解IgA肾病治疗最新进展——WCN 2025回顾
急性肾盂肾炎前瞻观察:哪些因素左右患者出院后的肾脏结局?
紧跟指南,护肾趁早!T2DM相关CKD治疗须与时俱进
肾域华章丨中大一院肾内科研究揭示IgA肾病伴肾病综合征患者的临床病理特征及与预后的关系
容易纠缠不清的病魔!泌尿系感染之肾盂肾炎,不容小觑
APRIL在IgA肾病治疗中的潜力
中国国医节 | 传承与创新:中西合璧挑战狼疮肾炎——黄芪的作用
蛋白尿与年轻人心搏骤停相关——CKD较严重者,风险更高
JASN|补体抑制剂治疗IgA肾病有望实现两个月给药一次?国际IgA肾病领军者Barratt教授最新研究揭晓
病例分享|不期而遇的困扰!丙肝患者短期内出现尿量减少,肌酐升高,警惕罕见的冷球蛋白血症肾病
2025年世界肾脏日:您的肾脏还好吗?早检查=保健康
ADPKD患者肾功能越差,疼痛频率越高,对睡眠的影响越显著
前沿进展|ORIGIN 2期研究结果重磅揭晓:阿塞西普长期治疗IgA肾病有效且安全
患者小课题|别让糖尿病伤了肾——如何早期发现糖尿病肾病
世界肾脏日丨早检查,保健康,拉紧心肾损伤警报线,优化T2DM相关CKD管理策略
Nature子刊|一文全解狼疮性肾炎相关CKD的管理理念与未来研究方向
狼疮性肾炎:突破传统,探索治疗新前沿
IgA肾病:IgA1免疫复合物的面面观
两款药物即将上市!FDA批准呋塞米注射液用于治疗CKD水肿;接受Obinutuzumab治疗狼疮肾炎的补充许可申请
慢性肾脏病患者的“症状关卡”,如何巧妙通关?
“心”感染,“肾”也跟着坏掉?感染性心内膜炎相关性肾炎,究竟是怎么一回事儿?
CKD相关心肌病的早期诊断与规范治疗
睡眠质量差,血液透析患者的“隐形杀手”!
WCN中国之声 | 郝传明教授:低氧诱导因子脯氨酰羟化酶抑制剂在慢性肾脏病贫血治疗中的两面性
探索替尔泊肽在肾脏疾病中的双重激动作用:GLP-1激动剂与潜在GIP介导的获益
什么是CKD相关心肌病?
IgA肾病的新兴疗法与当前争议
警惕!应用噻嗪类利尿剂后出现早期低钠血症,死亡风险或将大幅攀升!
高强度间歇训练显著降低老年人肾功能快速下降风险
指南共识 | 2024 ACR狼疮肾炎诊疗指南更新解读:从序贯治疗到联合免疫靶向的范式转变
病例分享丨中年男子3个月内肾功能快速恶化,原因究竟为何般?这种临床危重症,值得警惕
前沿进展丨常染色体显性多囊肾病患者的肾脏非线性生长模式与不良预后密切相关
糖衣炮弹下的肾脏危机!糖尿病最常见、最严重的并发症之一——糖尿病肾脏疾病
患者小课堂| IgA 肾病:症状背后的真相与应对策略
NEJM丨伊普可泮治疗IgA肾病Ⅲ期临床研究APPLAUSE-IgAN结果揭晓
狼疮性肾炎:流行病学特征与发病机制的最新研究进展
Kidney360|从成像模式看中国ADPKD患者临床特征及肾脏结局走向
NDT丨蛋白尿还是白蛋白尿?IgA肾病风险预测的关键指标再评估
WCN 2025|非奈利酮早期起始,持续治疗对于最大化患者临床效益至关重要
对激素(全身或肠道释放型布地奈德)耐药的肾病综合征范围蛋白尿的IgA肾病:他克莫司能否作为替代药物?
WCN 2025|非奈利酮显著降低蛋白尿,且疗效与安全性不受肾切除术史影响
病例分享 | 血透老人多病共存,内环境如同“纸糊“!棘手局面,肾病科医师如何破局?
WCN 2025|非奈利酮在肾移植后患者中安全有效,值得进一步探索
患者小课堂丨肾虚、肾亏是慢性肾炎吗?
NEJM前沿速递|阿曲生坦治疗IgA肾病Ⅲ期ALIGN试验的中期分析结果正式见刊
微小病变肾病,肾病综合征的第三大原因!“微小”病变也不容忽视,及时准确诊疗很关键
奥妥珠单抗有效保护LN患者的肾功能,显著减少LN发作,还具有减少糖皮质激素使用的潜力:NOBILITY试验事后分析
CKJ|浆细胞与补体或许是MN的潜在治疗靶点
揭秘BAFF、APRIL在IgA肾病中的作用以及治疗研究进展
