编者按:布地奈德这个成分也不算新鲜,一直都是呼吸科、消化科的常用药,属于糖皮质激素,目前有三种市售布地奈德口服制剂:Entocort、Budenofalk和Cortiment。Nefecon(布地奈德肠溶胶囊)是皮质类固醇布地奈德的一种新型口服制剂,FDA和EMA已批准布地奈德肠溶胶囊用于伴有疾病快速进展风险的原发性免疫球蛋白A(IgA)肾病成人患者[1~2]。近日,云顶新耀正式宣布国家药品监督管理局(NMPA)已批准耐赋康®NEFECON®(布地奈德肠溶胶囊)在中国附条件上市,用于治疗具有进展风险的原发性IgA肾病成人患者,以降低蛋白尿水平。那么都是布地奈德成分,其他口服制剂是否可以替换Nefecon,用来治疗IgA肾病呢?在第17届IgA肾病国际研讨会(IIGANN 2023)上发布的一项研究,比较4种制剂中布地奈德的溶出度,以确定其互换性,该研究结果对上述问题给出了答案。
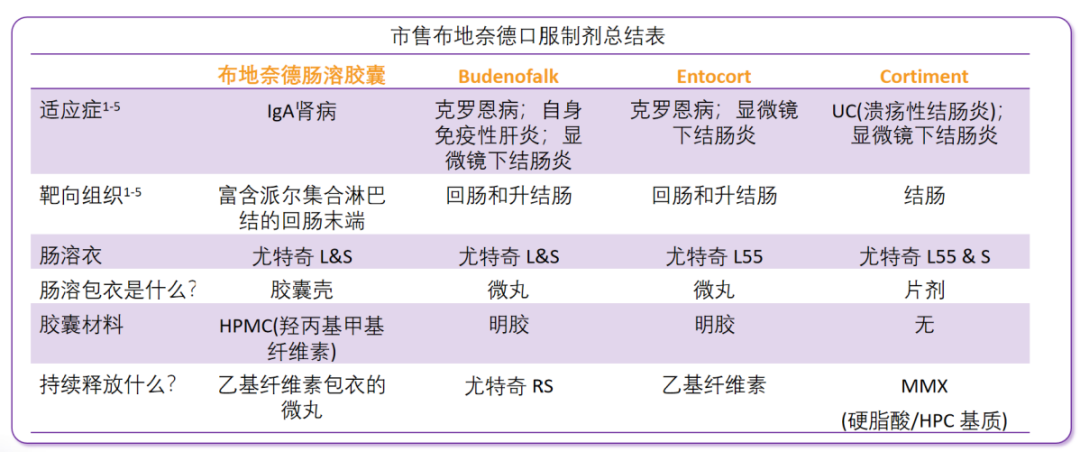
4种布地奈德口服制剂有何差异(下表)[1~5]
Nefecon(布地奈德肠溶胶囊):Nefecon是全球首个IgA肾病靶向对因治疗药物,专为治疗IgA肾病而研制,每粒肠溶胶囊含布地奈德4mg,通过特殊的制作工艺,靶向作用于回肠末端的黏膜 B 细胞(包括派尔集合淋巴结),胶囊溶解后,三层包衣微丸持续稳定释放布地奈德,高浓度覆盖整个靶区域,从而减少诱发IgA肾病的Gd-IgA1产生,进而在发病机制上游阶段治疗IgA肾病。作为首个靶向IgA肾病源头——肠道黏膜B细胞免疫调节剂,耐赋康Ⅲ期研究NefIgArd的中国数据结果显示,Nefecon对中国人群具有稳定肾功能、延缓肾功能恶化达66%、降低蛋白尿与改善血尿的作用,且安全性良好[6],Nefecon是目前首个看到2年肾功能保护结果的新药。
Budenofalk(布地奈德胶囊):Budenofalk是一线抗炎药和局部作用的糖皮质激素,适应证为轻度至中度回盲肠Crohn克罗恩病(一种肠道自身免疫性疾病)、自身免疫性肝炎、显微镜下结肠炎,靶向部位为回肠和升结肠。
Entocort(布地奈德胶囊):Entocort是一种新型的局部起效的布地奈德制剂,它可以明显缓解多数患者通常难以治疗的症状,目前所批准的适应证为累及回肠和升结肠的轻到中度活动性Crohn(克罗恩)病及显微镜下结肠炎,靶向部位为回肠和升结肠。
Cortiment(布地奈德胶囊):Cortiment在一种新型口服片剂配方中含有布地奈德,这是一种局部作用的糖皮质激素,利用MMX®多心房结肠给药技术。目前所批准的适应证为溃疡性结肠炎(UC)、显微镜下结肠炎。UC是一种炎症性肠病(IBD),在结肠内部产生炎症和溃疡,Cortiment的靶向部位为结肠。
表1.4种布地奈德口服制剂的详细差异
四种制剂的溶出情况与其适应证相关
研究者采用溶出实验,比较四种不同制剂中布地奈德的溶出度。首先将药品样品在酸性环境中暴露2小时,代表在空腹状态的胃中的最长停留时间,然后再暴露于缓冲液3小时,代表通过小肠,最后进行了两组实验(图1)[7]:
实验一:标准 USP 质控设计条件(USP标准方法),肠道pH值为6.8,缓冲容量为30 mmol/L/pH(缓冲容量是指使单位体积缓冲溶液的pH改变1个单位时,所需加入的强酸、强碱的物质的量,是衡量缓冲溶液缓冲能力大小的尺度,单位mol/L/pH或mmol/L/pH。)
实验二:生物相关性溶出度方法,在肠道pH值为6.5,使用较低浓度缓冲液更好地反映体内肠道环境,缓冲容量为12mmol/L/pH。
研究采用超高效液相色谱法分析样品,f2 统计量用于检测溶出度曲线之间的相似性,以布地奈德肠溶胶囊作为参比进行计算。
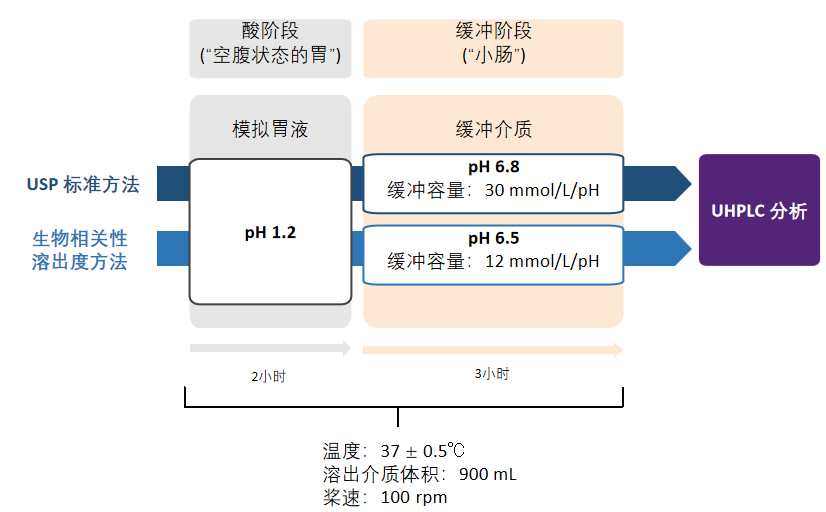
图1.标准USP和生物相关性溶出度方法总结
在实验的酸性环境阶段(模拟胃液)中,无制剂释放大量布地奈德,因此,仅显示了缓冲(模拟肠道)阶段的数据,研究结果发现:
Nefecon(布地奈德肠溶胶囊):对于布地奈德肠溶胶囊,进入缓冲阶段后1小时胶囊崩解并开始释放布地奈德,布地奈德在相对较短的时间内释放,从约1小时开始,在3小时内完成,该释放模式对应于布地奈德局部释放于富集派尔集合淋巴结的回肠。
Budenofalk(布地奈德胶囊):在3小时的试验期间,Budenofalk在生物相关性溶出度方法的介质中未释放布地奈德。在较高pH值的标准美国药典(USP)缓冲液中,Budenofalk延迟2小时后释放布地奈德,这与回肠末端释放的一些布地奈德一致,但大量转移至结肠。
Entocort(布地奈德胶囊):由于其肠溶包衣在较低pH 环境中稳定,Entocort在进入缓冲阶段后立即开始释放布地奈德,释放持续3小时以上,第1小时几乎释放80%,表明其主要在近端小肠释放。
Cortiment(布地奈德胶囊):在3小时的试验期间,Budenofalk在生物相关性溶出度方法的介质中未释放布地奈德。Cortiment在两种方法的肠道环境中均未能释放布地奈德,表明根据其UC适应证,在结肠开始释放。
四种制剂在肠环境中释放布地奈德的溶出曲线存在差异
根据标准USP方法和生物相关性溶出度方法,分析布地奈德在缓冲液(肠)中的溶出曲线,四种制剂在肠环境中释放布地奈德的溶出曲线均存在差异(图2)。
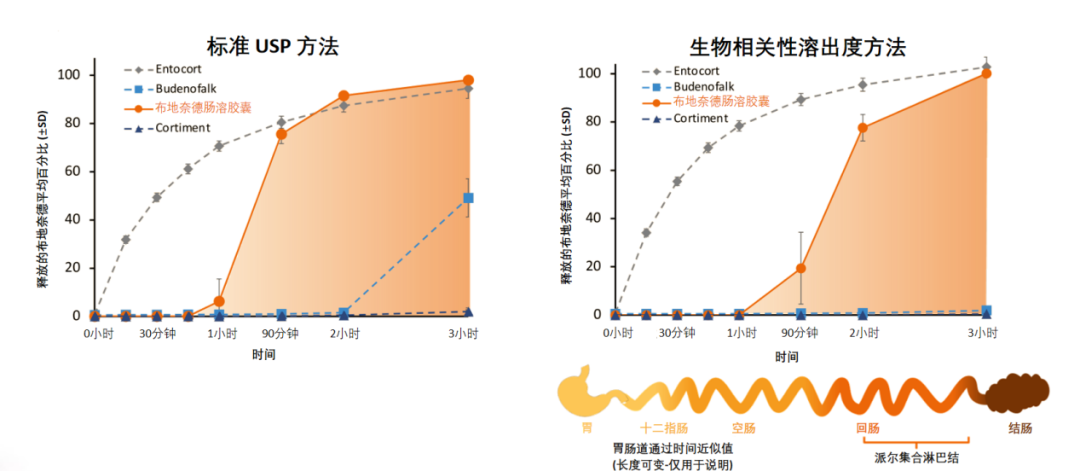
图2.根据标准 USP 方法和生物相关性溶出度方法,分析布地奈德在缓冲液(肠)中的溶出曲线
以布地奈德肠溶胶囊作参比,三种制剂均不符合溶出曲线的相似性标准,所有f2 值均< 50,不符合溶出曲线之间相似性标准(宽边距)(表2)。
表2.Entocort、Budenofalk和 Cortiment与布地奈德肠溶胶囊溶出曲线对比的f2值

结语
虽然成分相同,都是布地奈德,但4种布地奈德制剂的剂量、给药条件和批准的适应证差异很大。该研究也证实每种制剂都具有与其个体治疗目标一致的独特溶出特性。在肠道环境下1小时后,Nefecon(布地奈德肠溶胶囊)中布地奈德快速释放,预期布地奈德局部释放于派尔集合淋巴结富集的回肠,具有靶向作用以下调Gd-lgA1产生,进而在发病机制上游阶段治疗IgA肾病。f2分析显示溶出曲线存在明显差异,表明布地奈德制剂在药学或治疗上不可互换,临床不能用其他的布地奈德制剂替代Nefecon(布地奈德肠溶胶囊)用于治疗IgA肾病。
因此,对需要采用Nefecon(布地奈德肠溶胶囊)治疗的IgA肾病患者如有条件请一定抓住中国澳门的慈善援助机会,既可早治疗早获益,同时还可大大减少总体治疗成本,改善预后和节省开支一举两得!
扫描下图二维码参与“保肾赋康援助项目(二期)”

参考文献
1.STADA Arneimittel.Kinpeygo (Nefecon) SmPC.2023.2.Callditas Therapeutics AB. Tarpeyo (Nefecon) US PI.20213.Tillott Pharma UK Limited. Entocort SmPC 2019. 4.Dr.Falk Pharma UK Ltd.Budenofalk SmPC 2020.5.Ferring Pharmaceuticals Ltd.Cortiment SmPC 2020.6.Hong Zhang, et al. Long-Term Renal Benefit with Nefecon in Chinese Patients with Primary Immunoglobulin A Nephropathy: Two-Year NefIgArd Trial Results. Presented at: ASN Kidney Week 2023. TH-PO1123.7.Jennifer Dressman, et al. 2023 IIgANN. Comparison of the dissolution profile of Nefeconwith three other commercially availableoralformulations of budesonide:lmplications for interchangeability.
